Funktionsweise von Solarzellen
Allgemeines
Die heute (Frühjahr 2017) meistens eingesetzten Solarzellen bestehen im wesentlichen aus Silizium. Hierbei unterscheidet man zwischen Solarzellen aus amorphen, polykristallinen und monokristallinen Silizium. Die Unterschiede sind in der Art der Herstellung des Siliziums begründet. Allen drei Gemeinsam ist das Ausgangsmaterial, Siliziumdioxid, dass in Form von Sand in nahezu beliebiger Menge vorhanden ist. Silizium ist mit etwa 28 % eines der häufigsten Elemente der Erdkruste und wird uns also vorerst nicht ausgehen :-)
Solarzellen wandeln Sonnenenergie in elektrische Energie um. Solche aus monokristallinem Silizium besitzen hier bei mit bis zu 25 % den höchsten Wirkungsgrad der konventionellen siliziumbasierten Solarzellen, sind aber auch am teuersten. Polykristallines Silizium liefert Solarzellen mit einem Wirkungsgrad von bis zu 20 % zu einem moderaten Preis während amorphes Silizium praktisch nur zur Herstellung von Solarzellen mit niedrigem Wirkungsgrad max 15 %) zu günstigen Preisen, etwa für Taschenrechner oder andere Kleingeräte geeignet ist. (Quelle der Wirkungsgrade: http://www.photovoltaiksolarstrom.de/photovoltaiklexikon/wirkungsgrad)
Herstellung von Silizium
Um eine Solarzelle herzustellen muss zunächst das Silizium aus dem Siliziumdioxid gewonnen werden. Hierzu wird das Siliziumdioxid mit Kohle vermischt und in einem Ofen eingeschmolzen. Hierbei erhält man bei 2000 °C stark verunreinigtes Rohsilizium und Kohlenmonoxid.
SiO2 + 2 C -> Si + 2 CO
Das so gewonnen Rohsilizium ist allerdings noch nicht zur Herstellung von Solarzellen geeignet. Es muss zunächst gereinigt werden. Hierzu wird es mit Chlorwasserstoff bei 300-400 °C in leichtflüchtiges Trichlorsilan überführt.
Si + 3 HCl -> SiHCl3 + H2
Da das so gewonnen Trichlorsilan einen recht niedrigen Siedepunkt (31,8 °C) hat, kann es recht leicht verdampft werden, während die Verunreinigungen als Feststoffe zurückbleiben. Das gasförmige Trichlorsilan kann dann an abgeleitet und an anderer Stelle als Reinstoff wieder verflüssigt werden. Durch diese Destillation, die beispielsweise auch bei der Herstellung von Branntwein aus Wein ganz ähnlich durchgeführt wird, erhält man nun nahezu reines Trichlorsilan. Aus dem Trichlorsilan kann nun durch thermische Zersetzung bei etwa 1100 °C in einer Wasserstoffatmosphäre hochreines Silizium gewonnen werden.
SiHCl3 + H2 -> Si + 3 HCl
Diese Aufwendige Herstellung des hochreinen Siliziums ist einer der Gründe, für die recht hohen Kosten von Solarzellen und anderen Produkten aus Silizium. Das auf diese Weise gewonnen Silizium kann nun direkt zur Herstellung von amorphen Solarzellen benutzt werden. Um polykristallines Silizium herzustellen, wird das reine Silizium zunächst eingeschmolzen und dann langsamen abgekühlt. Durch die langsame Abkühlung entstehen nun einzelne größere Kristalle. Monokristallines Silizium ist in der Herstellung am aufwendigsten, denn wie der Name schon sagt, handelt es sich hierbei um einen einzigen, sehr großen Kristall, der nur sehr langsam aus der Schmelze wächst.
Um aus diesem Silizium, egal ob amorph, poly- oder monokristallin eine Solarzelle herzustellen, sind noch einige weitere Schritte notwendig.
Aufbau einer Solarzelle
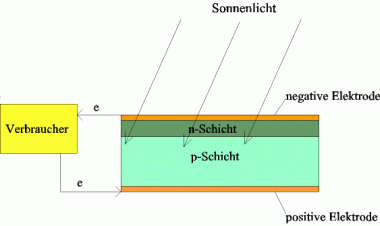
Eine Solarzelle besteht im wesentlichen aus zwei Schichten Silizium. Die der Sonne zugewandte Seite des Siliziums wird hierbei mit einer kleinen Menge eines Elementes der fünften Hauptgruppe des Periodensystems, z.B. Phosphor oder evtl. auch Arsen, versetzt. Eine solche Versetzung mit einer geringen Menge eines anderen Materials wird Dotierung genannt. Bei Dotierungen mit Phosphor und seinen Verwandten spricht man von einer n-Dotierung. Diese n-dotierte Schicht (oder kurz n-Schicht) muss so dünn sein, dass sie Lichtdurchlässig ist, denn die entscheidenden Vorgänge für die Erzeugung einer elektrischen Spannung geschehen erst darunter, in der p-dotierten Schicht. Diese besteht aus Silizium, dass meist mit Bor oder einem anderen Element der dritten Hauptgruppe dotiert wird. Die elektrische Spannung, die in Folge der Lichteinstrahlung entsteht, kann nun durch zwei Elektroden zwischen der Ober- und Unterseite der Solarzelle abgegriffen werden. Hierzu muss auf der Oberseite der Solarzelle eine Lichtdurchlässige Elektrode aufgebracht werden, denn das Licht darf durch die Elektrode nicht von der eigentlichen Solarzelle abgehalten werden.
Entstehung der elektrischen Spannung
Wie kann nun diese Konstruktion zur Erzeugung einer elektrischen Spannung genutzt werden? Um das verstehen zu können muss zunächst einiges über den Aufbau der Atome und die Bindungen zwischen den Atomen wissen. Zwei Dinge sind hierfür von Bedeutung; die Halbleitereigenschaften des Siliziums und die unterschiedliche Dotierung der beiden Schichten.
Halbleiter
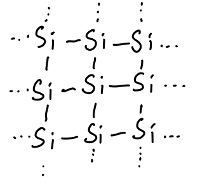
Halbleiter verhalten sich bei tiefen Temperaturen wie Isolatoren, d.h. sie leiten den Strom nicht. Erst bei hinreichend hoher Temperatur oder bei Energiezufuhr auf anderem Weg, etwa durch Licht, werden sie elektrisch leitend, wenngleich auch jetzt die Leitfähigkeit noch viel geringer ist, als in Metallen. Die Ursache hierfür ist die Art der Bindung zwischen den einzelnen Siliziumatomen. Das Silizium besitzt als Element der 4. Hauptgruppe des Periodensystems vier sogenannte Valenzelektronen und bildet aufgrund seines Nichtmetallcharakters mit diesen vier Elektronen vier Elektronenpaarbindungen zu seinen Nachbarn aus. In diesen vier Bindungen sind die Valenzelektronen fixiert und können nicht aus der Bindung heraus verschoben werden. Genau dies wäre aber nötig, damit ein Strom fließen könnte. Es müssten Elektronen des Siliziums mehr oder weniger frei durch den Kristall bewegt werden können. Bei Metallen ist dies möglich, da die metallische Bindung die Elektronen nicht fest an ihren Platz bindet, sondern ihnen erlaubt sich durch das gesamte Metall weitgehend frei zu bewegen. Man spricht in diesem Zusammenhang von Valenz- und Leitungsband. In Metallen werden die Atome durch Elektronen verbunden, die sich im Leitungsband befinden und frei durch das gesamte Metall verschoben werden können. Bei Halb- und Nichtleitern werden die Atome durch Elektronen verbunden, die genau an dieser Stelle zwischen den beiden durch sie verbundenen Atomen fixiert sind und sich eben nicht bewegen können. Man könnte auch sagen: Bei elektrischen Leitern fallen Valenz- und Leitungsband zusammen, bei Nicht- und Halbleitern nicht.
- Valenzband : Das Valenzband wird durch alle Valenzelektronen eines Kristalls gebildet. Unter einem solchen Band versteht man nicht etwa einen Ort im inneren des Kristalls, sondern eine bestimmte Menge Energie, die jedes Elektron besitzen muss. Das bedeutet, dass das Valenzband durch die Energie gekennzeichnet ist, die die Valenzelektronen besitzen. Die Lage des Valenzbandes hängt von der Art der Atome ab und ist für jedes Material anders.
- Leitungsband Das Leitungsband ist wie das Valenzband kein Ort im inneren des Materials, sondern ein Energieniveau, auf dem es Elektronen möglich ist, durch den gesamten Kristall zu wandern. Das Leitungsband ist dadurch gekennzeichnet, dass alle Elektronen, die eine "Leitungsbandenergie" besitzen frei beweglich sind und beim Anlegen einer äußeren Spannung dieser folgen können. Elektronen im Leitungsband, d.h. mit der dazu passenden Energie, tragen zu elektrischen Leitfähigkeit des Stoffes bei.
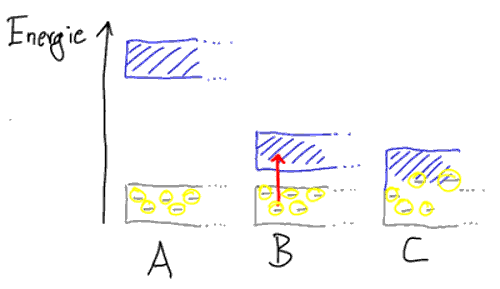
Eine detaillierte Erklärung zum Bändermodell findet sich in vielen Physikbüchern und auch auf Wikipedia. Wen es im Detail interessiert...
Ob eine Substanz nun ein Leiter, ein Halbleiter oder ein Isolator ist, hängt von der Energiedifferenz zwischen dem Valenzband und dem Leitungsband ab. Bei Metallen sind die Valenzelektronen zugleich auch die Leitungselektronen und die Energiedifferenz ist Null. Metalle sind Leiter. Bei Isolatoren ist die sogenannte Energielücke zwischen Valenz- und Leitungsband so groß, dass keine Elektronen aus dem Valenz- in das Leitungsband wechseln können. Da das Leitungsband hier normalerweise keine Elektronen enthält, kann eine solche Substanz normalerweise keinen Strom leiten. Bei einem Halbleiter gibt es nun eine solche Energielücke aber sie ist recht gering und unter gewissen Umständen, etwa bei erhöhter Temperatur, können einzelne Valenzelektronen aus dem voll besetzten Valenzband in das Leitungsband wechseln, da sie aus der Umgebung die für diesen Übergang nötige Energie aufnehmen können (z. B. Wärme oder auch Lichtenergie, roter Pfeil in der Abbildung zum Bändermodell). Auf diese Weise erhält man ein freies Elektron im Leitungsband, dass nun zur Leitfähigkeit des Materials beträgt. Gleichzeitig entsteht aber auch eine positive Lücke, ein sogenanntes Defektelektron, im Valenzband. Dieses Defektelektron kann nun unter dem Einfluss einer äußeren Spannung innerhalb des Valenzbandes in die entgegengesetzte Richtung wie das zugehörige Elektron im Leitungsband wandern, indem sie ständig von benachbarten Elektronen gefüllt wird, die dann ihrerseits eine Lücke zurück lassen. Damit trägt die Lücke zur elektrischen Leitfähigkeit des Halbleiters ebenso bei, wie das Elektron im Leitungsband.
n-Dotierung
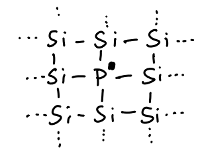
Die oben beschriebene Eigenleitung des Halbleiters kann durch den gezielten Einbau von Störstellen modifiziert werden. Wenn Gitteratome des Siliziums gezielt durch andere Atome ersetzt werden, kann die Leitfähigkeit des Materials gezielt modifiziert werden. Werden anstelle weniger vierwertiger Siliziumatome ebenso viele fünfwertige Atome (etwa Phosphor) in das Gitter eingebaut, so spricht man, wie bereits erwähnt, von einer n-Dotierung. Hierbei werden vier der fünf Valenzelektronen des Phosphors benutzt, um kovalente Bindungen zu den benachbarten Siliziumatomen auszubilden - in der Abbildung als Striche zwischen den Atomen dargestellt. Da das fünfte Elektron - als Punkt gezeichnet - keinen Bindungspartner findet, ist es nur relativ lose gebunden und kann bereits bei geringer Energiezufuhr in das Leitungsband abgegeben werden. Durch diese Dotierung kann also die Elektronendichte im Leitungsband erhöht werden, ohne das sich die Zahl der Defektelektronen vergrößert. Man spricht hier von einem Donator.
p-Dotierung
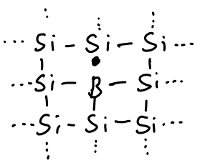
Bei den sogenannten p-dotierten Halbleitern findet eine genau entgegengesetzte Dotierung statt. Durch Dotierung mit dreiwertigen Atomen (etwa Bor oder Aluminium) stehen nur drei Elektronen für die vier Bindungen zu den vier benachbarten Siliziumatomen zur Verfügung. Ein viertes Elektron wird an dieser Stelle sehr leicht eingebaut. Ein solches Atom heißt Akzeptor, da es ein Defektelektron erzeugt. Das "Loch" ist in der Abbildung oberhalb des Boratoms (B) als "nichts" zu sehen. Der Punkt über dem Loch ist das Elektron des Siliziumatoms, dem der Bindungspartner fehlt weil das Bor ein Elektron zu wenig hat.
Die Grenzschicht
Daraus ergibt sich, dass in n-Leitern der Einfluss von Donatoren überwiegt und der Stromfluss hauptsächlich durch Elektronen zustande kommt, während im p-Leiter die Löcher überwiegen und hauptsächlich zur Leitfähigkeit beitragen.
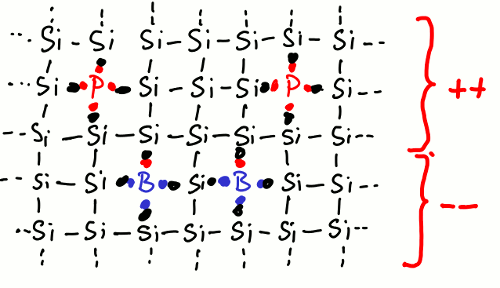
Ohne äußere Spannung ergibt sich in der Grenzschicht zwischen p- und n-Schicht dann folgendes Bild: Im p-Gebiet herrscht gegenüber dem n-Gebiet ein großer Überschuss an Löchern. Durch diese große Änderung der "Lochkonzentration" im Bereich der Grenzschicht zwischen p- und n-Bereich werden ständig Löcher in den n-Leiter diffundieren. Aufgrund des Überschusses an Elektronen im n-Leiter bewegen sich die Elektronen währenddessen in die entgegengesetzte Richtung. Berücksichtigt man die Vorzeichen der Ladungsträger, so beobachtet man eine negative Aufladung der p-Schicht und eine positive Aufladung der n-Schicht im Bereich der Grenzschicht. Natürlich geht diese Aufladung nicht endlos weiter. Mit jedem Ladungsträger steigt die Spannung zwischen den beiden Bereichen und es wird jedem zusätzlichen Ladungsträger immer schwerer fallen, diese Spannung zu überwinden und der oben beschriebenen Wanderungsrichtung zu folgen. Irgendwann ist ein Zustand erreicht, bei dem sich diese beiden Effekte genau ausgleichen und keine weitere Ladungstrennung mehr erfolgt.
Da die in das n-Gebiet eintretenden Löcher dort ebenso mit Elektronen rekombinieren wie die in das p-Gebiet eintretenden Elektronen mit den dort vorhanden Löchern, verarmt die Umgebung der des pn-Übergangs insgesamt an beweglichen Ladungsträgern. Hierdurch wächst der elektrische Widerstand dieses Gebietes stark an und es entsteht die elektrische Doppelschicht oder Sperrschicht.
Lichteinfall
Wenn nun Licht auf die Solarzelle fällt und die dünne n-Schicht durchdringt, so kann die Energie dieses Lichts in der p-Schicht unter Umständen (wenn seine Energie ausreicht) ein Elektron aus dem Valenz- in das Leitungsband anheben. Da nun das p-dotierte Silizium ein guter Leiter für Löcher aber ein schlechter für Elektronen ist und das n-dotierte Silizium entsprechend ein guter Leiter für Elektronen und ein schlechter für Löcher ist, stauen sich die Elektronen in der p-Schicht. Infolge des hierdurch bedingten Elektronenüberschusses diffundieren die Elektronen vom Ort ihrer Freisetzung weg. In der Regel gelangen sie dabei ohne Rekombination mit einem Defektelektron bis in die Grenzschicht. Von dort werden sie durch das herrschende elektrische Feld in die n-Schicht befördert um dann über den Außenkontakt in den äußeren Stromkreis übergehen zu können. In diesem können sie nun ihre Energie an den Verbraucher übertragen, um dann über den unteren Kontakt wieder in den Halbleiter zu gelangen, wo sie in der p-Schicht mit einem Defektelektron rekombinieren.
