Redoxreaktionen als Elektronenübertragungsreaktionen
Redoxreaktionen werden im Allgemeinen und auch hier auf mbzi.de als Sauerstoffübertragungsreaktionen beschrieben. Nach dieser Vorstellung ist eine Oxidation eine Reaktion unter Sauerstoffaufnahme und eine Reduktion ist eine Reaktion unter Sauerstoffabgabe. Eine Redoxreaktion ist dann die Übertragung von Sauerstoffatomen von einem Atom zu einem anderen.
Diese Vorstellung wird im Folgenden erweitert. Alle Sauerstoffübertragungen sind auch nach dem gleich beschriebenen Modell noch immer Redoxreaktionen. Allerdings kommen weitere Reaktionen hinzu, die nach dem bisherigen Modell keine Redoxreaktionen waren.
Die Unzulänglichkeit der bisherigen Definition
Betrachten wir bespielhaft die Reaktion von Kupfer mit Sauerstoff zu Kupferoxid und mit Schwefel zu Kupfersulfid:
- Kupfer + Sauerstoff → Kupferoxid
- Kupfer + Schwefel → Kupfersulfid
Nach der sauerstoffbasierten Definition ist die erste der beiden Reaktionen eine Oxidation, die zweite aber nicht. Logisch, denn bei der zweiten Reaktion ist ja auch kein Sauerstoff beteiligt. In der ersten Reaktion wird demnach das Kupfer oxidiert, in der Zweiten nicht. Betrachten wir nun die Reaktion zunächst auf automarer Ebene und danach die Elektronenübertragung finden wir das auf einmal gar nicht mehr so logisch....
- 2 Cu + O2 → 2 CuO
- 8 Cu + S8 → 8 CuS
In beiden Reaktionen reagiert das Kupferatom mit einem Element der sechsten Hauptgruppe, dessen Atome je zwei Elektronen aufnehmen. Es reagiert immer ein Kupferatom mit einem Atom der sechsten Hauptgruppe - jedes Kupferatom gibt also zwei Elektronen ab; und zwar in jeder der beiden Reaktionen:
- Cu → Cu2+ + 2 e-
- Cu → Cu2+ + 2 e-
In der oberen der beiden Reaktionen wird das Kupfer oxidiert, in der unteren dagegen nicht? Aha! Es passiert zweimal das Gleiche mit dem Kupferatom; einmal soll es eine Oxidation sein und das andere Mal nicht - nicht logisch!
Die neue Definition als Elektronenübertragungsreaktion
Da bei den beiden oberen Reaktionen mit dem Kupferatom in beiden Fällen das Gleiche passiert, sollte man auch in beiden Reaktionen von einer Oxidation des Kupfers sprechen. In diesem Fall muss die Definition unabhängig vom Reaktionspartner (Sauerstoff bzw. Schwefel) erfolgen. Sie muss sich alleine auf die Reaktion des Kupferatoms stützen.
Gibt ein Atom bei einer Reaktion ein oder mehrere Elektronen ab, spricht man von einer Oxidation. Eine Oxidation ist eine Elektronenabgabe.
Das Gegenteil der Oxidation sollte die Reduktion sein:
Nimmt ein Atom bei einer Reaktion ein oder mehrere Elektronen auf, wird es reduziert. Eine Reduktion ist eine Eektronenaufnahme.
Mit dieser Definition werden in den obigen Beispielen sowohl der Sauerstoff als auch der Schwefel reduziert, denn jedes Sauerstoff- bzw. Schwefelatom nimmt zwei Elektronen auf.
- O2 + 4 e- → 2 O2-
- S8 + 16 e- → 8 S2-
Diese Definition als Elektronenaufnahme bzw. -abgabe macht es unmöglich, dass eine Oxidation ohne eine Reduktion auftreten kann, denn abgegebene Elektronen müssen auch immer wieder irgendwo aufgenommen werden. Aus diesem Grund können in dieser Definition Oxidation und Reduktion immer nur gemeinsam auftreten. Jede Oxidation bzw. Reduktion ist damit immer Teil einer Redoxreaktion:
Eine Redoxreaktion ist eine Elektronenübertragungsreaktion.
Durch diese Erweiterung des Redox-Begriffes weg von der bloßen Übertragung von Sauerstoffatomen hin zu der viel allgemeineren Elektronenübertragung sind jetzt viel mehr Reaktionen als Redox-Reaktionen anzusehen.
Formale Darstellung in Redox-Gleichungen
Bildung aus Teilgleichungen
Diese Variante der Darstellung eignet sich sehr gut für die ersten Gehversuche im Umgang mit Redox-Gleichungen und lässt sich einfach auf formale Korrektheit prüfen. Möglicherwiese deshalb ist diese Darstellung im schulischen Umfeld sehr gebräuchlich. Zur Ermittlung der Reaktionsgleichung für die Redoxreaktion, der Redox-Gleichung, wird die Reaktion formal in je eine Teilgleichung für die Oxidation und eine für die Reduktion aufgeteilt.
Reaktion von Kupfer mit Sauerstoff
- Ox: Cu → Cu2+ + 2 e- | ·2
- Red: O2 + 4 e- → 2 O2-
- Redox: 2 · Cu + O2 + 4 e- → 2 · Cu2+ + 2 · 2 e- + 2 O2-
Für jede der beiden Teilgleichungen wird die kleinstmögliche Anzahl Teilchen verwendet, die diese Teilreaktion gerade so möglich machen - in diesem Fall also ein Kupferatom und ein Sauerstoffmolekül. Im Anschluss wird das kleinste gemeinsame Vielfache der in jeder der Gleichungen angegebenen Elektronenzahl gesucht und jede der beiden Teilreaktionen so "erweitert", dass gleich viele Elektronen aufgenommen wie abgegeben werden. Dazu schreibt man einen Faktor hinter einen "Befehlsstrich" ( | ) hinter die Gleichung, so wie oben bei der Oxidation geschehen. Die Gleichung selbst wird nicht verändert.
Zum Abschluss wird, wie früher in der Grundschule beim "schriftlichen Addieren" die Summe beider Gleichungen unter Berücksichtigung der Faktoren gebildet. Da hierbei auf beiden Seiten des Reaktionspfeils gleich viele Elektronen stehen, werden diese zum Schluss gestrichen.
Reaktion von Kupfer mit Schwefel
- Ox: Cu → Cu2+ + 2 e- | ·8
- Red: S8 + 16 e- → 8 S2-
- Redox: 8 · Cu + S8 + 16 e- → 8 · Cu2+ + 8 · 2 e- + 8 S2-
In diesem Fall ist die Oxidation die Gleiche, wie schon bei der vorherigen Reaktion, muss aber wegen der insgesamt 16 in der Reduktion benötigten Elektronen achtmal gemacht werden, damit die Reduktion einmal möglich ist.
Fazit
Die Darstellung in Teilgleichungen ist recht raumgreifend und erfordert drei Gleichungen für eine Reaktion - schon eher viel Aufwand. Andererseits sieht man durch den Vergleich der beiden Reaktionen auch einen wesentlichen Vorteil: Die Oxidation des Kupfers wird in beiden Reaktionen durch die exakt gleiche Gleichung beschrieben. Man erhält also eine relativ übersichtliche Menge aus eher nur wenigen Teilgleichungen, aus denen sich alle (!) Redoxreaktionen aufbauen lassen. Diese übersichtliche Menge Teilgleichungen kann man in Tabellen z.B. zusammen mit weiteren Daten zu dieser Teilgleichung, wie etwa dem Energieumsatz, sammeln. So wird die gesamte Welt der Redoxreaktionen aus wenigen einfachen Bausteinen aufgebaut und vollkommen berechenbar - sehr cool.
Darstellung in einer Gleichung
Mit etwas Erfahrung im Umgang mit Redox-Gleichungen will man nicht mehr immer drei Gleichungen für eine Reaktion schreiben müssen. Dazu lassen sich die Teilgleichungen direkt in die Redox-Gleichung integrieren.
Reaktion von Kupfer mit Sauerstoff
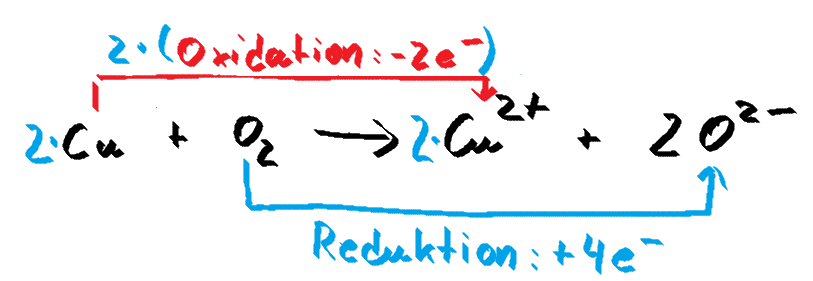
Bei dieser Darstellungsweise beginnt man mit den beiden an der Elektronenübertragung beteiligten Teilchen (in der Abbildung schwarz gezeichnet) und bestimmt die an der Oxidation (rot) bzw. der Reduktion (blau) eines der Atome beteiligten Elektronen. Nun wird wieder das kleinste gemeinsame Vielfache der Elektronenzahlen bestimmt, um die Reaktion auszugleichen. Die Faktoren, die sich daraus ergeben, werden vor die an der Reaktion beteiligten Teilchen geschrieben - fertig..... zumindest meistens. Manchmal müssen noch weitere an der Reaktion beteiligte Teilchen, wie Protonen oder Wassermoleküle ausgeglichen werden. Diese Anpassung erfolgt dann im letzten Schritt durch "Atome zählen".
Reaktion von Kupfer mit Schwefel
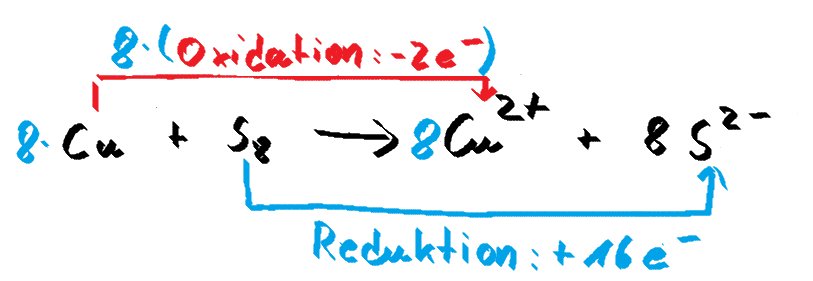
Auch hier sieht man: Die Oxidation des Kupfers ist in beiden Fällen identisch. Die Oxidation (rot) der Kupferatome wird in beiden Reaktionen gleich dargestellt und durch den Reaktionspartner nicht beeinflusst. Der Reaktionspartner ändert jeweils nur den Faktor "davor", genau wie bei der Darstellung mit drei Teilgleichungen.
Fazit
Diese Darstellung in einer Gleichung ist mit dem Stift auf einem Zettel mit etwas Erfahrung kompakter und schneller erstellt. Formal gibt es zwischen den beiden Darstellungen eigentlich keinen Unterschied - in beiden Fällen wird die Redox-Gleichung aus einer Oxidations- und einer Reduktionsgleichung zusammengesetzt. Der Vorteil des Baukastensystems ist also hier genauso vorhanden wie oben. Ein Nachteil ergibt sich aber in unserer Computerzeit durch die Darstellung. Die drei Teilgleichungen lassen sich relativ geschmeidig als "Texte" eingeben. Die Darstellung in einer Gleichung mit Pfeilen für die Elektronenübertragung ist immer ein grafisches Element, dass sich nicht so schön in den Text integriert und etwas mehr Aufwand bei der "hübschen" Darstellung macht, was man ja auch hier deutlich sieht.
