Chemische Reaktionen
Früher oder später stolpert wohl jeder über den Begriff der "chemischen Reaktion". Für manchen scheint alles völlig klar zu sein, während für andere alles völlig unklar ist. Der folgende Text wird versuchen für die zweite Gruppe etwas Licht in das Dunkel zu bringen. Im Grunde steckt die Erklärung ja schon im Namen: Eine "Chemikalie" reagiert auf eine Andere. Was ist allerdings die Folge? Wir werden sehen!
Die Entstehung neuer Stoffe
Der Begriffe der "Chemikalie" ist in unserer Gesellschaft wie auch der Begriff "Chemie" sehr negativ belegt - "Chemikalien" sind böse, denkt man. Tatsächlich spricht man in der Chemie von Stoffen und meint damit jede denkbare Substanz, also auch Wasser, Zucker, Salz,.... und all die anderen Substanzen in unserer Welt; nicht nur die Gefährlichen. Diese Stoffe sind nicht schon immer da gewesen, sondern irgendwann aus anderen Stoffen entstanden.Genauso werden sie irgendwann wieder zu anderen Stoffen werden damit scheinbar verschwinden. Stoffe können also neu entstehen und auch wieder "verschwinden".
Ein Vorgang, bei dem ein neuer Stoff aus einem oder mehreren anderen Stoffen entsteht, wird "chemische Reaktion" genannt.
Erkennen einer chemischen Reaktion
Da man einen Stoff an seinen Eigenschaften erkennt, erkennt man die Entstehung eines neuen Stoffes an den geänderten Stoffeigenschaften. Wenn bei irgendeinem Vorgang die Stoffeigenschaften wie Farbe, Biegsamkeit, Dichte,... verändert werden, bedeutet dies: Es hat eine chemische Reaktion stattgefunden und ein neuer Stoff ist entstanden. Der neue Stoff ist das Produkt der Reaktion während der Stoff, aus dem dieser neue Stoff entstanden ist, der Ausgangsstoff, Edukt genannt wird. Natürlich kann es bei einer chemischen Reaktion mehrere Edukte und auch mehrere Produkte geben.
Darstellung als Reaktionsschema
Chemische Reaktionen werden in einem Reaktionsschema oder einer Reaktionsgleichung dargestellt. Reaktionsgleichungen enthalten chemische Formeln und sollen hier erstmal nicht betrachtet werden. In einem Reakionsschema stellt man die Reaktion aus mehreren Edukten zu mehreren Produkten wie folgt dar:
Edukt_1 + Edukt_2 -> Produkt_1 + Produkt_2
Gelesen wird so ein Reaktionsschema als "Edukt_1 reagiert mit Edukt_2 zu Produkt_1 und Produkt_2". Der Pfeilt (->) wird als "reagiert zu" gelesen. Links vom Pfeil stehen die Stoffe, wie sie vor der chemischen Reaktion waren. Rechts vom Pfeil stehen die Stoffe nach der chemischen Reaktion. Das Reaktionsschema enthält also eine Art zeitlichen Ablauf. Übertragen auf das Backen von Keksen stünden links vom Pfeil die Zutaten und rechts davon die fertigen Kekse; links ist vor dem Backen und rechts ist danach.
Beispiele
Verbrennung von Gas
Wir kennen es beispielsweise vom Feuerzeug, vom Gasgrill, der gasbetriebenen Zentralheizung oder dem gasbetriebenen Auto (LPG oder CNG). Wir "verbrennen" Gas, auch wenn es nicht immer das völlig identische Gas ist. Im Wort "verbrennen" ist bereits enthalten, dass das Gas nach diesem Vorgang "weg" ist. Außerdem entsteht bei dieser Verbrennung Kohlendioxid für die Verbrennung ist Sauerstoff aus der Luft erforderlich. Weniger bekannt ist, dass außerdem Wasser entsteht. Bei der Verbrennung von Gas handelt es sich demnach um eine chemische Reaktion, bei der die beiden Edukte Gas und Sauerstoff zu den beiden Produkten Kohlendioxid und Wasser reagieren.
Gas + Sauerstoff -> Kohlendioxid + Wasser
Natürlich verbrennen wir das Gas nicht, um Kohlendioxid oder Wasser herzustellen. Vielmehr wollen wir die Energie nutzen, die bei der Verbrennung frei wird. Die Reaktionsenergie ist ein Teil der chemischen Reaktion und bei Verbrennungen wird relativ viel Energie frei. Je mehr Energie wir benötigen, desto mehr von dem "Brennstoff" müssen wir verbrennen und desto mehr klimaschädliches Kohlendioxid entsteht. Deshalb gibt es einen sehr direkten Zusammenhang zwischen unserem Energieverbrauch und dem Treibhauseffekt!
Atmen
Das Atmen selbst ist keine chemische Reaktion. Allerdngs atmen wir das Gasgemisch Luft ein, dass zu etwa 21 % aus Sauerstoff besteht. Wenn wir die Luft wieder ausatmen ist der Sauerstoffgehalt deutlich gesunken während der Kohlendioxidgehalt sehr deutlich gestiegen ist. Wohin geht aber der Sauerstoff und wo kommt plötzlich das Kohlendioxid her? Im Grunde ist der Vorgang ganz ähnlich dem der Verbrennung von Gas. Wir nehmen mit unserer Nahrung Fette und Kohlenhydrate auf, deren "Verbrennung" unseren Körper mit Energie versorgt. Mit dieser Energie können wir unsere Körpertemperatur auf 37 °C halten und uns bewegen.
Die "Verbrennung" der Kohlenhydrate, wie z.B. Zucker und Fette aus unserer Nahrung in unseren Körpern dient also dem gleichen Zweck wie die Verbrennung von Gas in unseren Maschinen - der Energieversorgung. Bei der Verbrennung entstehen wieder durch die chemische Reaktion mit Sauerstoff Kohlendioxid und Wasser:
Fett + Sauerstoff -> Kohlendioxid + Wasser
Zucker + Sauerstoff -> Kohlendioxid + Wasser
Das Atmen versorgt also die Energie liefernden chemische Reaktionen mit dem benötigten Sauerstoff und transportiert gleichzeitig eines der eigentlich nicht benötigten Reaktionsprodukte weg, das Kohlendioxid.
Wenn mir mehr Energie benötigen, weil wir z.B. Sport machen, müssen wir also mehr atmen um mehr chemische Reaktionen machen zu können. Wir kommen "außer Atem". Außerdem setzen wir mehr Fette und Kohlenhydrate um und nehmen also ab, wenn wir nicht mehr essen. Wenn wir hingegen ständig mehr Energie zuführen, als wir durch Bewegung wieder umsetzen, legt unser Körper Energiedepots in Form von Fett an - wir werden dick.
Akku laden bzw. entladen

Spätestens seit der Erfindung des allgegenwärtigen Smartphones sind auch Akkus ein ständiges Thema. Durch das Elektroauto wird die Bedeutung von Akkus künftig noch weiter steigen. Wie funktioniert nun wohl so ein Akku? Tatsächlich lässt sich "Strom" oder besser "elektrische Energie" nicht in Gefäße füllen und aufbewahren. Der Akku ist also kein "Stromspeicher". Trotzdem kann er Energie speichern und ist ein "Energiespeicher". Dazu nutzt er chemische Reaktionen, die allerdings für die Verwendung in Akkus besondere Eigenschaften haben müssen.
- Die chemische Reaktion muss elektrische Energie liefern statt Wäremenergie wie bei Verbrennungen.
- Durch die Zufuhr von elektrischer Energie muss die Reaktion rückwärts ablaufen.
- Die Menge an umgesetzter Energie muss möglichst groß sein, damit in wenig Volumen möglichst viel Energie gespeichert werden kann.
Da je nach Akkutyp die genauen Reaktionen unterschiedlich sein können, will ich hier nicht auf Details dazu eingehen. Allen Akkus ist aber gemeinsam, dass sie im geladenen Zustand aus zwei "Halbzellen" bestehen, die die beiden Reaktionspartner enthalten. Beim "Entladen" des Akkus kommt es nun zu einer chemischen Reaktion zwischen diesen beiden Reaktionspartnern, weil durch den elektrischen Verbraucher nach dem Einschalten Strom fließen kann. Dieser Stromfluss ermöglicht die Energie liefernde chemische Reaktion zwischen den beiden Halbzellen. Je mehr Strom fließt, desto schneller läuft die Reaktion ab und desto schneller ist der Akku "leer".
Im leeren Akku sind die Edukte der Reaktion dann (überwiegend) verbraucht und fast nur noch die Produkte vorhanden. Die chemische Reaktion wird so langsam, dass sie die Energieversorgung des elektrischen Verbrauchers nicht mehr gwährliesten kann - wir sagen, der Akku ist leer. Zum Aufladen wird der Akku dann an einer Stromquelle angeschlossen, wodurch die chemische Reaktion rückwärts läuft und die ursprüngliche Füllung durch die umgekehrte chemische Reaktion neu entsteht. Die chemische Reaktion beim Laden nimmt Energie auf und speichert sie in den Stoffen in den beiden Halbzellen.
Rosten
Beim Rosten verändert sich zunächst nur die Oberfläche und später dann das ganze Eisen. Nur Eisen rostet! Hierbei wird aus einem silbrig glänzenden, biegsamen Metall ein spröder, rötlich-brauner krümmeliger Feststoff. Offensichtlich entsteht also aus dem Eisen ein neuer Stoff - Rost. Diese chemische Reaktion wollen wir eigentlich nicht und wir betreiben großen Aufwand, um z.B. das Rosten unserer Autos zu verhindern; ohne langfristigen Erfolg. Früher oder später fällt alles Eisen dem Rost zum Opfer. Das Rosten ist eine chemische Reaktion von Eisen mit Wasser und Sauerstoff zu Rost.
Eisen + Sauerstoff + Wasser -> Rost
Wenn Wasser oder Sauerstoff fehlen, wird das Rosten erheblich verlangsamt, während Salz wie in Meerwasser das Rosten erheblich beschleunigen kann, obwohl es selbst nicht Teil der chemischen Reaktion ist.
Obst wird braun
Wenn Obst braun wird, ist dies ebenfalls eine chemische Reaktion, wie man an der Farbänderung sieht. Andere Farbe - anderer Stoff. Grundsätzlich gibt es zwei Wege, wie es zu braunem Obst kommt. Bei der sogenannten enzymatischen Bräunung wird das Obst überreif. Dieser Prozess wird vom Obst selbst durch Enzyme veranlasst und ist eher langsam. Bei der nichtenzymatischen Bräunung kommt es dagegen zu einer chemischen Reaktion zwischen Stoffen aus dem Obst mit dam Sauerstoff der Luft. Dieser Prozess ist deutlich schneller, wird aber normalerweise von der Schale des Obstes verhindert. Deshalb sieht man die nichtenzymatische Bräunung sehr gut bei angebissenen Äpfeln oder bei geschälten und klein geschnittenen Bananen. Je nach Sorte und Reifegrad kann man schon nach wenigen Minuten braune Stellen entdecken.
Die chemische Reaktion durch den Luftsauerstoff lässt sich in der Küche leicht verlangsamen und viele kennen den "Trick". Etwas Zitronensaft im Obstsalat und das Obst wird nicht so schnell braun, aber warum? Das Vitamin-C (Ascorbinsäure) im Zitronensaft reagiert sehr leicht mit Sauerstoff und verbraucht ihn dabei. Dadurch schützt es das Obst vor dem Kontakt mit dem Sauerstoff und so vor der Bräunung. Deshalb wird Ascorbinsäure als Antioxidant vielen Lebensmittel zugesetzt um die Bräunung zu verhindern, denn das klappt nicht nur beim Obstsalat sondern auch bei der Fleischwurst.
Chemische Reaktionen und Teilchenmodell
Das einfache Teilchenmodell kann nicht erklären, wie es zur Bildung neuer Stoffe kommen kann. Dort wird angenommen, dass alle Stoffe aus kugelförmigen Teilchen bestehen und das diese Teilchen für verschiedene Stoffe verschieden sind während alle Teilchen eines Stoffes untereinander gleich sein sollen. Trotzdem gehen wir im Folgenden mal davon aus, dass diese Annahme zumindest für einige Stoffe richtig ist.
Teilchen und Atome
Betrachten wir des Grillers liebste chemische Reaktion: Die Verbrennung von Kohle. Bei dieser chemischen Reaktion reagiert Kohlenstoff mit Sauerstoff zu Kohlendioxid bzw. besser Kohlenstoffdioxid.
Kohlenstoff + Sauerstoff -> Kohlenstoffdioxid
Bei dieser Reaktion wird relativ viel Energie frei, die für die hohe Temperatur verantwortlich ist. Der Name des Produkts legt bereits nahe, dass es sich dabei um einer Verbindung aus Kohlenstoffteilchen und Sauerstoffteilchen handelt; genauer aus immer einem Kohlenstoffatom, dass mit je zwei (di) Sauerstoffatomen verbunden ist.

Im Teilchenmodell muss der Kohlenstoff als Feststoff aus geordneten, eng aneinander liegenden Kugeln dargestellt werden. Da Sauerstoff der Luft (O2) immer in Form zweiatomiger Moleküle vorkommt und gasförmig ist, wird er im Teilchenmodell in ungeordneten "Zweierpäckchen" mit realtiv großem Abstand gezeichnet. Im ebensfalls gasförmigen Kohlenstoffdioxid (CO2) ist immer ein Kohlenstoffatom mit zwei Sauerstoffatomen verbunden. Diese "Dreierpäckchen" befinden sich wie bei allen gasförmigen Stoffen frei beweglich mit realtiv großem Abstand im Raum (vgl. einfaches Teilchenmodell)
Elemente und Verbindungen
Das Beispiel zeigt, dass es eigentlich zwei Sorten von Stoffen gibt:
- Stoffe die nur aus einer Sorte kleinster Teilchen bestehen (Elemente) und
- Stoffe die aus der Verbindung mehrerer, verschiedener kleinster Teilchen hervorgehen (Verbindungen).
Diese kleinsten Teilchen der Elemente sind die Atome. Sie werden in der Chemie als unteilbar und unzerstörbar angesehen. Alles was mit Atomspaltung oder so zu tun hat, ist keine Chemie :-) sondern Physik.
Nun ist die Zahl der Atome sehr begrenzt. Es gibt etwas über 100 unterschiedliche Atome, die im "Periodensystem der Elemente" dargestellt werden. Aus diesen Atomen kann aber eine unendlich große Zahl verschiedener Verbindungen erhalten werden, sodass die meisten Stoffe unserer Lebenswelt Verbindungen sind. Die verschiedenen Atome unterscheiden sich u.a. durch ihre Masse und ihre Größe und einiges mehr. Die unterschiedlichen Verbindungen unterscheiden sich meistens durch Art und Anzahlverhältnis der beteiligten Atome. Allerdings ist manchmal auch einfach nur die Anordnung der Atome relativ zueinander unterschiedlich. Für den Augenblick reicht aber die Feststellung, dass die Zahl der Verbindungen unbegrenzt ist.
Energie bei chemischen Reaktionen
In den Beispielen oben wurde es bereits deutlich: Bei jeder chemischen Reaktion wird immer auch Energie umgesetzt. Grundsätzlich unterscheidet man zwei Fälle
- Bei der Reaktion wird in den Stoffen gespeicherte chemische Energie frei gesetzt. Dies ist z.B. an einer Wärmeabgabe während der Reaktion erkennbar. Solche Reaktionen sind exotherm. Hierzu zählen u. a. alle Verbrennungsprozesse.
- Bei einer chemischen Reaktion wird Energie aus der Umgebung aufgenommen und in den Produkten gespeichert. Diese Reaktionen sind endotherm. Endotherme Reaktionen beobachten wir nicht so häufig in unserer Lebenswelt, weil sie wegen der meistens fehlenden Energie nicht von selbst ablaufen. Beispiele sind das oben beschriebene Aufladen eines Akkus oder auch die Photosynthese, bei der Lichtenergie in den bei der Photosnythese erzeugten Kohlenhydraten gespeichert wird.
Allerdings laufen auch exotherme chemische Reaktionen nicht immer von alleine ab. Ein Feuer muss man anzünden. Von selbst startet es nicht - wir müssen den Energieumsatz während der Reaktion detaillierter betrachten, um das zu verstehen.
Energieumsatz und Teilchenmodell
Betrachten wir noch mal die Reaktion von Kohlenstoff mit Sauerstoff zu Kohlenstoffdioxid: Damit sich Kohlenstoffdioxid bilden kann, muss zunächst ein Kohlenstoffatom so weit aus dem Atomverband der festen Kohle gelöst werden, dass dieses Kohlenstoffatom mit dem Sauerstoff reagieren kann. Hierzu ist Energie nötig.
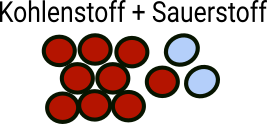
Im Kohlenstoffdioxid befindet sich das Kohlenstoffatom zwischen den beiden Sauerstoffatomen. Deshalb muss auch die Bindung zwischen diesen beiden Atomen so weit gelöst werden, dass eine Reaktion mit dem Kohlenstoff möglich wird. Auch hierfür ist Energie nötig. Der so erreichte Zustand ist in der Abbildung dargestellt. Unter Energiezufuhr wurden ein Kohlenstoffatom und zwei Sauerstoffatome für die Reaktion "aktiviert". Die hierzu zugeführte Energie heisst deshalb auch Aktivierungsenergie.
Nun können die "aktivierten" Atome neu miteinander zu Kohlenstoffdioxid verknüpft werden. Bei dieser Neuverknüpfung wird Energie frei. Bei einer exothermen Reaktion wird am Ende mehr Energie frei als zur Aktivierung nötig war; bei einer endothermen Reaktion ist es weniger.
Energieumsatz im zeitlichen Verlauf der Reaktion
Exotherme chemische Reaktionen
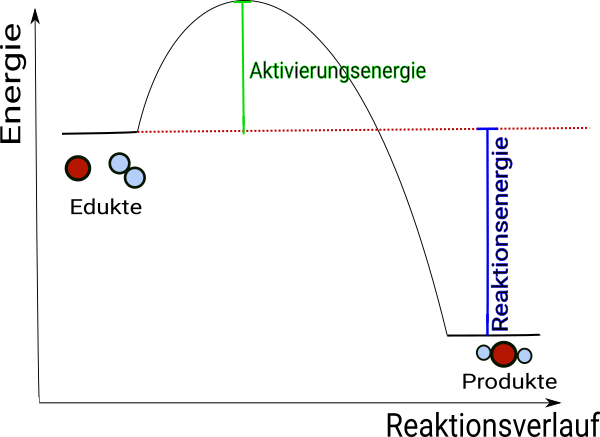
Betrachten wir die Reaktion zwischen genau einem Kohlenstoffatom und zwei Sauerstoffatomen noch ein bisschen genauer im zeitlichen Verlauf: Zunächst muss die Aktivierungsenergie zu den Atomen hinzugefügt werden. Dies ist nötig, um die Atome innerhalb ihres "Atomverbandes" der Edukte soweit voneinander zu lösen, dass sie für die chemische Reaktion aktiviert sind. Die in den Stoffen gespeicherte Energie erreicht danach einen Maximalwert. Ab jetzt können die Atome zu den Produkten, in diesem Fall genau einem Kohlenstoffdioxidmolekül, neu verknüpft werden. Hierbei wird Energie aus den Stoffen frei gesetzt und die in genau diesen betrachteten drei Atomen gespeicherte Energie erreicht nach der Reaktion einen neuen Minimalwert. Die Reaktionsenergie kommt also aus den Stoffen heraus.
Endotherme chemische Reaktionen
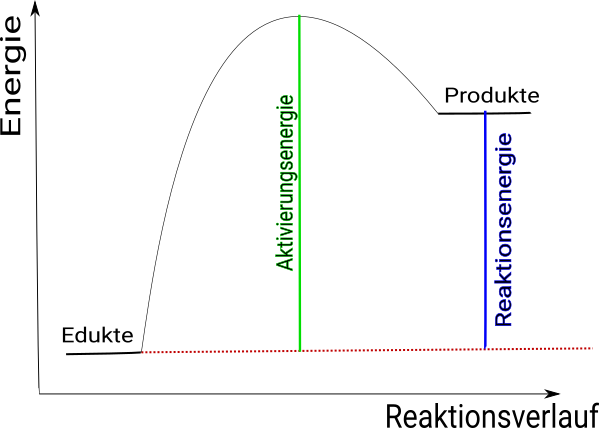
Auch bei einer endothermen chemischen Reaktion betrachten wir genau so viele einzelne Atome im Verlauf der Reaktion, wie mindestens für die Bildung einer Einheit der Produkte nötig sind. Zunächst müssen die Atome der Edukte für die Reaktion aktiviert werden, d.h. soweit aus dem Atomverbund der Edukte gelockert werden, dass eine Reaktion möglich wird. Bei einer endothermen chemischen Reaktion ist hierfür in der Regel relativ viel Energie nötig. Danach werden die Atome zu den Produkten neu verknüpft. Hierbei wird allerdings weniger Energie frei, als zuvor aufgewendet werden musste, sodass die Reaktion insgesamt Energie erfordert, d.h. endotherm ist. Die Reaktionsenergie wird den Stoffen also hinzu gefügt.
Zusammenfassung
- Bei einer chemischen Reaktion wird mindestens ein neuer Stoff gebildet.
- In einer chemischen Reaktion wird immer Enerhie umgesetzt.
- Bei einer chemischen Reaktion bleiben alle Atome unverändert erhalten, werden aber umgruppiert und neu miteinander verknüpft.Eine chemische Reaktion ist eine Atomumgruppierung.
