Das chemische Gleichgewicht
Bei den Redoxreaktionen wurde die Atmungsreaktion bzw. die Photosynthese als Beispiele für Oxidations- bzw. Reduktionsreaktionen benutzt. Betrachten wir diese Reaktionen erneut, fällt auf, dass die eine Reaktion die Umkehrung der Anderen ist.
Glukose + Sauerstoff → Kohlenstoffdioxid + Wasser ; exotherm
C6H12O6 + 6 O2 → 6 CO2 + 6 H2O ; ΔRH=-2808 kJ/mol
Kohlenstoffdioxid + Wasser → Glukose + Sauerstoff ; endotherm
6 CO2 + 6 H2O → C6H12O6 + 6 O2 ;ΔRH=2808 kJ/mol
Grundsätzlich sind alle chemischen Reaktionen in dieser Weise umkehrbar. Fügt man die bei einer exothermen chemischen Reaktion frei werdende Energie dem Reaktionsgemisch in geeigneter Weise wieder zu, kann die Reaktion als dann endotherme Reaktion "rückwärts" ablaufen. Im Folgenden wird diese Umkehrbarkeit und die Steuerung der "Richtung" genauer betrachtet. Da die Photosynthese allerdings ein ziemlich komplexer Vorgang ist, wählen wir ein deutlich einfacheres Beispiel: Das Lösen von Kohlensäure in Wasser.
Der Wassersprudler
Kohlensäure wird von uns oft und gerne in Wasser gelöst, etwa beim Bier zapfen, bei der Herstellung von Cola oder anderer Limonaden oder bei der Sektherstellung. Der Vorgang ist immer der Gleiche. Zu Hause können wir das vollkommen jugendfrei mit dem Wassersprudler ausprobieren.

Beschreibung
Auf dem Bild sieht man ganz links den Wassersprudler im Augenblick des "Sprudelns", in Mitte sieht man das gleiche Wasser einige Minuten später aber noch am Wassersprudler, also in der noch immer verschlossenen Flasche. Ganz rechts ist das Wasser im Augenblick des Öffnens fotografiert.
Beim Sprudeln wird gasförmige "Kohlensäure" bzw. eigentlich Kohlenstoffdioxid mit erhöhtem Druck durch ein Röhrchen unterhalb der Wasseroberfläche in das Wasser gepresst, weshalb man ein heftiges Sprudeln sieht. Wenn der Druck in der Plastikflasche zu sehr steigt, entweicht das Gas durch ein Überdruckventil. Dabei dürfte auch ein großer Teil der Luft, die sich anfangs oberhalb des Wassers in der Flasche befand, heraus gedrückt werden.
Nach dem Sprudeln befindet sich also über dem Wasser eine Gasatmosphäre, die gegenüber der Raumluft deutlich mehr Kohlenstoffdioxid enthält und unter leicht erhöhtem Druck steht. Wenn man nun einige Zeit wartet, verschwinden die meisten Gasblasen aus dem Wasser und man erhält fast blasenfreies aber kohlensäurehaltiges Wasser wie in der Bildmitte.
Wenn man nun die Flasche öffnet, entweicht mit einem Zischen der Überdruck. Außerdem wird die kohlenstoffdioxidreiche Atmosphäre oberhalb des Wassers durch normale Luft ersetzt. Als Folge davon bilden sich praktisch sofort Gasblasen im Wasser die nach oben aufsteigen und deshalb auf dem Foto etwas unscharf sind. Der genau gleiche Effekt tritt beim Öffnen jedes kohlensäurehaltigen Getränks auf.
Das Kohlenstoffdioxid löst sich also verstärkt in Wasser, wenn sich oberhalb der Oberfläche viel Kohlenstoffdioxid befindet und es verlässt die Lösung wieder, wenn Oberhalb des Wassers wenig Kohlenstoffdioxid ist. Wir können also durch die Menge an Kohlenstoffdioxid oberhalb des Wassers steuern, ob sich das Kohlenstoffdioxid als Kohlensäure in Wasser löst oder ob es aus dem Wasser wieder heraus geht. Also genau wie die Photosynthese/Atmung ein Prozess, der in beiden Richtungen ablaufen kann und wo die Ablaufrichtung beeinflussbar ist.
Chemie des Wassersprudlers
Wenn man den Kohlenstoffdioxidgehalt der Atmosphäre oberhalb des Wassers vergrößert, geht mehr gasförmiges Kohlenstoffdioxid in Lösung.
Kohlenstoffdioxid (gasförmig) → Kohlenstoffdioxid (gelöst)
CO2 (g) → CO2 (aq)
Dieser zunächst rein physikalische Prozess erhöht also die Menge des im Wasser gelösten Kohlenstoffdioxids. Diese Erhöhung führt dazu, dass das Kohlenstoffdioxid im Wasser vermehrt mit dem Wasser zu Kohlensäure reagiert:
Kohlenstoffdioxid + Wasser → Kohlensäure
CO2 + H2O → H2CO3
Da nun mehr Kohlensäure vorhanden ist, reagiert diese Kohlensäure durch Deprotonierung vermehrt zu Hydrogencaronat und teilweise weiter zu Carbonat:
Kohlensäure → Proton + Hydrogencarbonat
H2CO3 → H+ + HCO3-
Hydrogencarbonat → Proton + Carbonat
HCO3- → H+ + CO32-
Als Folge der gestiegenen Kohlendioxidkonzentration oberhalb des Wassers steigt also zunächst die Konzentration des gelösten Kohlendioxids und als Folge davon die Konzentration an Kohlensäure und dann die an Hydrogencarbonat und schließlich die an Carbonat. Logisch erscheint jetzt, dass alle diese Prozesse wieder zurück ablaufen, wenn man die Ursache entfernt, d.h. die Flasche öffnet und damit die Kohlendioxidkonzentration über dem Wasser wieder verringert.
Logisch - oder doch nicht?
Jetzt schwimmt da also so ein Carbonation (CO32-) in der Lösung rum und in dem Augenblick, in dem ich die Flasche öffne, weiß dieses Ion, dass es bitte jetzt sofort mit einem Proton zu Hydrogencarbonat und dann weiter zu Kohlensäure reagieren muss, die dann zu Kohlendioxid und Wasser zerfallen muss, damit das Kohlendioxid als Gas die Lösung verlässt. Das alles weiß das Carbonation und verhält sich dann entsprechend!? Wohl kaum. Aber wie geht das dann?
Wassersprudler und chemisches Gleichgewicht
Tatsächlich wissen Atome, Moleküle und Ionen nichts. Die Lösung des Problems muss also ohne intelligente und folgsame Teilchen zu finden sein.
Reaktionen ohne Ende
Tatsächlich kommen die oben beschriebenen Reaktionen niemals zum Stillstand. Die vier Reaktionen laufen die ganze Zeit ab. Es hört niemals auf. Es löst sich also ständig weiteres Kohlendioxid in Wasser und führt zu den drei nachfolgenden Reaktionen. Trotzdem scheint von außen betrachtet die Reaktion irgendwann aufzuhören, obwohl ja noch Kohlendioxid da ist. Auch das wäre ja irgendwie nicht logisch, denn warum sollte sich das Kohlendioxid anfangs im Wasser lösen und dann irgendwann nicht mehr. Wie könnte ein Kohlendioxidmolekül wissen, dass es jetzt genug ist und es sich nicht mehr in Wasser lösen darf? Es weiß es nicht und löst sich trotzdem in Wasser.
Allerdings sind alle chemischen Reaktionen umkehrbar und laufen also immer auch "rückwärts" ab. Während sich also Kohlendioxid in Wasser löst, wird immer gleichzeitig auch Kohlendioxid das Wasser verlassen.
Kohlenstoffdioxid (gasförmig) → Kohlenstoffdioxid (gelöst)
CO2 (g) → CO2 (aq)
Kohlenstoffdioxid (gelöst) → Kohlenstoffdioxid (gasförmig)
CO2 (aq) → CO2 (g)
Die Reaktion, wie auch die drei anderen, laufen also gleichzeitig vorwärts und rückwärts ab. Wenn beide Reaktionen dabei gleich schnell sind, spricht man von einem Gleichgewicht und von außen ist keine Veränderung mehr zu beobachten. Im Gleichgewicht lösen sich in jedem Augenblick genau gleich viele Kohlendioxidmoleküle in Wasser, wie wieder aus dem Wasser heraus gehen. Eine Gleichgewichtsreaktion läuft also immer zugleich in beiden Richtungen ab, was in der Reaktionsgleichung durch ⇄ anstelle von → dargestellt wird.
Kohlenstoffdioxid (gasförmig) ⇄ Kohlenstoffdioxid (gelöst)
CO2 (g) ⇄ CO2 (aq)
Störung des Gleichgewichts: Sprudeln und öffnen
Sprudeln
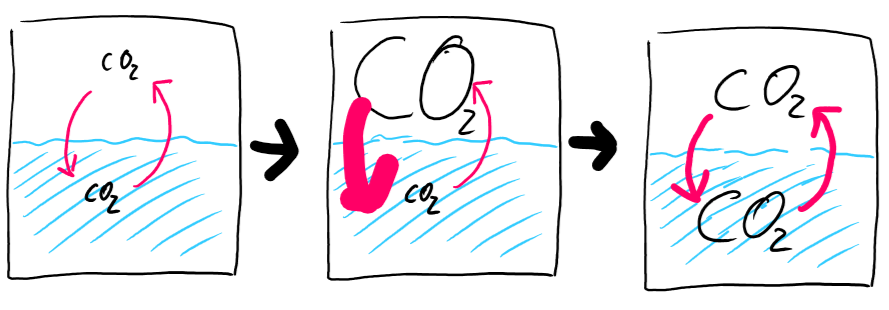
Beim Sprudeln wird die Menge des Kohlendioxids oberhalb der Wasseroberfläche stark vergrößert, weshalb der Lösevorgang beschleunigt wird. Die Umkehrreaktion ändert sich aber zunächst nicht. Das System befindet sich also nicht mehr im Gleichgewicht, weil sich Kohlendioxid schneller im Wasser löst, als es wieder heraus geht. Dadurch nimmt die Menge des gelösten Kohlendioxids zu, wodurch wiederum die Rückreaktion beschleunigt wird. Es gibt jetzt mehr gelöstes Kohlenstoffdioxid, wodurch in jedem Augenblick mehr Moleküle die Lösung verlassen. Gleichzeitig nimmt die Menge des Kohlendioxid über dem Wasser ab, wodurch der Löseprozess wieder langsamer wird. Irgendwann sind beide Reaktionen wieder gleich schnell und es stellt sich ein neues Gleichgewicht ein, bei dem aber gegenüber dem Zustand vor dem Sprudeln deutlich mehr Kohlendioxid in Wasser gelöst ist.
Öffnen
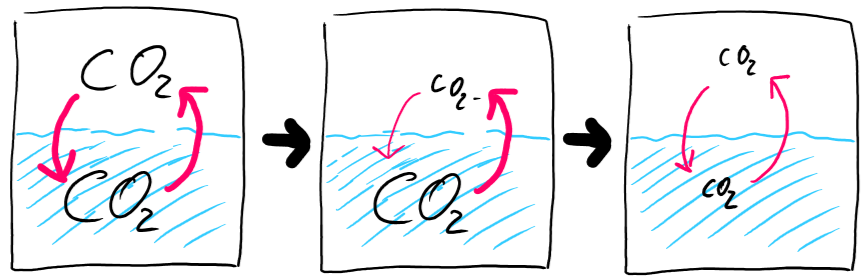
Beim Öffnen der Flasche passiert genau das Umgekehrte. Durch die plötzlich stark fallende Kohlendioxidskonzentration über dem Wasser wird der Prozess des Lösens schlagartig stark verlangsamt während die "Entlösung" noch gleich schnell ist. Das System befindet sich erneut im Ungleichgewicht, allerdings ist jetzt der Löseprozess viel langsamer als sein Umkehrung, weshalb Kohlendioxid aus der Lösung heraus geht. Dadurch nimmt wiederum die Menge des gelösten Kohlendioxids ab, weshalb dieser Prozess immer langsamer wird, bis sich schließlich irgendwann ein neues Gleichgewicht einstellt, in dem wieder sehr wenig Kohlendioxid gelöst ist und die Reaktion in beiden Richtungen wieder gleich schnell ist.
Ein dynamisches chemisches Gleichgewicht
Im Allgemeinen ist jede chemische Reaktion umkehrbar und damit ist auch jede chemische Reaktion eine Gleichgewichtsreaktion.
Edukt1 + Edukt2 ⇄ Produkt1 + Produkt2
Im Gleichgewichtszustand sind die Hin- und die Rückreaktion gleich schnell, weshalb durch die Hinreaktion in jedem Augenblick genau so viele Produktmoleküle gebildet weden, wie durch die Rückreaktion wieder zu Edukten werden.
Hinreaktion: Edukt1 + Edukt2 → Produkt1 + Produkt2
Rückreaktion: Produkt1 + Produkt2 → Edukt1 + Edukt2
Im Gleichgewicht, also wenn scheinbar keine Reaktion mehr stattfindet und trotzdem die ganze Zeit sehr viele Reaktionen ablaufen, liegt ein sehr dynamischer Zustand vor, weshalb man auch von einem dynamischen Gleichgewicht spricht. In diesem dynamischen Gleichgewicht führt jede Störung einer der beiden Reaktion zu einer Verschiebung des Gleichgewichts entweder auf die Seite der Produkte oder der Edukte, je nach dem, welche der beiden Reaktionen durch die Störung verlangsamt oder beschleunigt wird.
Befindet sich ein System im Gleichgewicht, sind Hin- und Rückreaktion gleich schnell und die Zusammensetzung des Reaktionsgemisches ändert sich nicht. mehr. Von außen betrachtet scheinen keine chemischen Reaktion mehr statt zu finden.
Einen einfachen Simulator für das chemische Gleichgwicht findest Du auf hier: Simulation eines chemischen Gleichgewichts
