Säure-Base-Definitionen
Definition
ist ein schwieriges Wort - vielfach wird geglaubt, eine Definition
sei eine Erklärung und tatsächlich ist auch in jeder Definition immer eine
Erklärung enthalten. Allerdings ist eine Definition mehr als das; es ist eine
Festlegung. Eine Säure-Definition ist also weniger eine
Erklärung des Begriffes als vielmehr eine Festlegung, was unter einer Säure
zu verstehen sein soll. Bei Säuren und Basen hat es in der Vergangenheit viele
unterschiedliche Begriffsdefinitionen gegeben, von denen im Wesentlichen drei
bis heute gebräuchlich sind und im Folgenden erläutert werden sollen. Eine
umfassende Auflistung liefert z.B. der Wikipedia-Artikel
zu Säure-Base-Konzepten.
Säure-Base-Definition nach Arrhenius
Die Säure-Base Definition von Svante Arrhenius ist die älteste, einfachste und unvollkommenste Vorstellung der drei auf dieser Seite beschriebenen Definitionen. Weil sie in der Praxis aber so wunderbar einfach ist, ist sie zugleich die Einprägsamste und hat sich womöglich deshalb bis heute erhalten.
Die Definition
Die Säure-Base-Definition nach Arrhenius beschränkt sich in ihrer Gültigkeit ausschließlich auf wässrige Lösungen. Außerhalb des Lösungsmittels Wasser gibt es in der Welt von Arrhenius keine Säuren oder Basen.
Eine Säure ist ein Stoff, der beim Lösen in Wasser Wasserstoffionen (Protonen, H+-Ionen) freisetzt. Eine Base setzt beim Lösen in Wasser hingegen Hydroxidionen (OH-) frei.
Diese Definition ist zunächst für viele Menschen sehr einleuchtend, weil sie direkt die beiden in wässrigen Lösungen relevanten Teilchen enthält. Saure wässrige Lösungen enthalten einen Überschuss an Protonen, während basische wässrige Lösungen einen Überschuss an Hydroxidionen enthalten. Daraus abgeleitet ergibt sich diese "einfache" Definition von Arrhenius quasi von selbst.
Beispiele
Die folgenden Reaktionsgleichungen zeigen die Reaktionen der Säuren bzw. Basen beim Lösen in Wasser. Das Wasser taucht in der Reaktionsgleichung nicht auf, da es "nur" das Lösungsmittel darstellt.
Säuren nach Arrhenius:
- Salzsäure: HCl → H+ + Cl-
- Schwefelsäure: H2SO4 → 2 H+ + SO42-
- Phosphorsäure: H3PO4 → 3 H+ + PO43-
- Salpetersäure: HNO3 → H+ + NO3-
- Flusssäure: HF → H+ + F-
- ...
Bei allen obigen Reaktionen dissoziiert die eigentlich als Molekül vorliegende Säure in zwei oder mehr Ionen. Diese Dissoziation wird durch das polare Lösungsmittel Wasser verursacht. Die Definition von Arrhenius beschreibt für die obigen Säuren und alle ähnlichen Stoffe sehr gut den sauren Charakter der links vom Reaktionspfeil stehenden Moleküle.
Da Wasserstoff ein Nichtmetall mit einer relativ hohen Elektronegativität ist, kommt das Wasserstoffion (H+) nicht in ionischer Form in Salzen vor. Stattdessen wird das Ion immer erst in einem ausreichend polaren Milieu gebildet und ist dann solvatisiert, d.h. von relativ fest angebundenen Lösungsmittelmolekülen wie z.B. Wassermolekülen umgeben. Freie Protonen (H+-Ionen) kommen praktisch niemals vor.
Basen nach Arrhenius
- Natronlauge: NaOH → Na+ + OH-
- Kalilauge: KOH → K+ + OH-
- ...
Die obigen Arrhenius-Basen sind Metallsalze, die das Hydroxidion bereits vor dem Lösen in Wasser als Anion im Ionengitter enthalten. Durch das Lösen im polaren Wasser dissoziieren die sowieso schon vorher vorhandenen Ionen Die "freien" solvatisierten (bzw. aquotisierten) Hydroxidionen befinden sich danach weitgehend unabhängig vom Kation in der Lösung. Das ist im Prinzip für fast alle Arrhenius-Basen der Fall.
Neutralisation
In "Saure und basische Lösungen" wurde bereits erwähnt, dass eine saure und eine basische Lösung sich gegenseitig neutralisieren, wenn sie im passenden Verhältnis gemischt werden. Der Grund hierfür ist in der Definition von Arrhenius relativ einfach zu verstehen: Die Hydroxidionen aus der basischen Lösung reagieren mit den Protonen aus der sauren Lösung zu Wasser:
OH- + H+ → H2O
Die so neutralisierte Lösung besteht dann aber nicht aus reinem Wasser, da die jeweils anderen Ionen aus der Säure und der Base noch immer in der Lösung sind. Aus den obigen Beispielen für Säuren und Basen werden nach der Neutralisation die H+-Ionen und die OH--Ionen "weg". Das andere Ion aus der Reaktionsgleichung der Säure bzw. Base bleibt aber unverändert in der Lösung, weshalb man bei der Neutralisation nach Arrhenius am Schluss eine wässrige Salzlösung erhält. Daher kommt der folgende, häufig in Schulbüchern zu findende Merksatz:
Säure plus Lauge ergibt Salz plus Wasser!
Richtiger wäre eigentlich: Saure Lösung plus basische Lösung gibt wässrige Salzlösung, aber das ist womöglich zu sperrig für die meisten Schulbücher.
Grenzen
Die Definition von Arrhenius kann den größten Teil der gängigen Säuren und Basen gut abbilden, hat aber zwei wesentliche Probleme:
- Die Definition von Arrhenius ist auf das Lösungsmittel Wasser beschränkt. Außerhalb von wässrigen Lösungen bleiben Säuren und Basen undefiniert.
- Von der Definition nach Arrhenius werden nur solche Säuren bzw. Basen erfasst, die das Proton (H+-Ion) bzw. das Hydroxidion (OH-) im Prinzip schon vorher enthalten. Reagiert ein Stoff beim Lösen in Wasser in der Weise mit dem Wasser, dass das relevante Ion eigentlich aus dem Wasser stammt, so wäre das Wasser die Säure bzw. die Base.
Beispiele für Stoffe, bei denen in der Definition von Arrhenius das Wasser die Säure bzw. Base darstellen würde, sind Bortriflourid, Aluminiumchlorid und praktisch alle anderen Lewis-Säuren und bei den Basen etwa Ammoniak und ähnlich reagierende Substanzen:
- Bortriflourid: BF3 + H2O → BF3OH- + H+
- Aluminiumchlorid: AlCl3 + H2O → AlCl3OH- + H+
- Ammoniak: NH3 + H2O → NH4+ + OH-
In den ersten beiden Beispielen "nimmt" das Bortriflourid bzw. das Aluminiumchlorid aus dem Wasser "ein Hydroxidion auf" und das verbleidende Proton aus dem Wassermolekül geht in Lösung und macht die Lösung sauer. In der Definition von Arrhenius müsste nun die Quelle des Protons und damit das Wassermolekül als Säure angesehen werden. Tatsächlich wird die Lösung aber durch die Zugabe von Bortrifluorid bzw. Alumniumchlorid sauer. Die Arrhenius-Definition macht hier also die "falsche" Substanz zur Säure.
Beim Ammoniak nimmmt das Ammoniakmolekül ein Proton aus dem Wasser auf und der Rest des Wassermoleküls, das Hydroxidion, macht die Lösung basisch. Hier würde in der Definition von Arrhenius das Wasser die Base sein und nicht das Ammoniakmolekül, dessen Zugabe die Lösung basisch werden lässt.
Säure-Base-Definition nach Brønsted
Die Definition von Brønsted ist gegenüber der von Arrhenius deutlich moderner und umfassender und beseitigt viele Nachteile der Vorstellung von Arrhenius. Die Brønsted-Definition reicht in den meisten Fällen aus um auch relativ komplexe Sachverhalte zu beschreiben und bleibt dabei aber noch relativ anschaulich, weshalb sie vermutlich heute die am häufigsten verwendete Säure-Base-Definition ist.
Die Definition
Die Säure-Base-Definition von Brønsted definiert Säuren und Basen unabhängig vom Lösungsmittel und deshalb in jedem Milieu gültig. Sie betrachtet nicht die Lösungen, sondern die Stoffe selbst, verzichtet auf die Einbeziehung des Hydroxidions und beschränkt sich ausschließlich auf das Proton.
Eine Säure ist ein Protonendonator.
Eine Base ist ein Protonenakzeptor.
Hierdurch ändert sich gegenüber der Vorstellung von Arrhenius bei den Säuren nicht sehr viel. Hier wie dort gibt die Säure das Proton ab.
Bei den Basen unterscheiden sich die Definitionen aber erheblich. Die auf das Hydroxidion gestützte Vorstellung von Arrhenius macht beispielsweise in der Natronlauge das Salz Natriumhydroxid (NaOH) zur Base. Da die Definition von Brønsted den Protonenakzeptor als Base betrachtet, ist nun nicht mehr das Natriumhydroxid die Base, sondern nur noch das Hydroxid. Da praktisch alle Hydroxide basisch reagieren und ihre basische Wirkung immer auf das Hydroxidion zurückzuführen ist, ist die Vorstellung von Brønsted hier viel treffender. Bei Arrhenius muss jedes Hydroxid eigenständig als Base betrachtet werden, obwohl das Kation (Na+, K+,...) überhaupt nichts zur basischen Reaktion beiträgt.
Beispiele
Die folgenden Beispiele zeigen die Reaktionen von Brønsted-Säuren und Basen unabhängig vom Reaktionspartner und vom Lösungsmittel. Da die Definition von Brønsted nicht an das Lösungsmittel "Wasser" gebunden ist, haben die folgenden Reaktionsbeispiele allgemeine Gültigkeit.
Säuren nach Brønsted:
- Salzsäure: HCl → H+ + Cl-
- Schwefelsäure: H2SO4 → 2 H+ + SO42-
- Phosphorsäure: H3PO4 → 3 H+ + PO43-
- Salpetersäure: HNO3 → H+ + NO3-
- Flusssäure: HF → H+ + F-
- ...
Der aufmerksame Leser wird bemerkt haben, dass ich die obigen Beispielreaktionen einfach aus den Beispielen für die Arrhenius-Definition kopiert habe.... Tatsächlich sind sich die beiden Definitionen für Säuren so ähnlich, dass man bei diesen einfachen Reaktionsgleichungen keinen Unterschied sieht.
Der Unterschied wird erst sichtbar, wenn man sich für den Grund der dargestellten Reaktion interessiert. Bei Arrhenius muss die Reaktion beim Lösen in Wasser stattfinden, andernfalls ist es keine Säure nach Arrhenius. In der Definition von Brønsted sind die obigen Reaktionen in jedem Fall Reaktionen einer Säure, egal mit welchem Reaktionspartner und in welchem Medium sie ablaufen.
Basen nach Brønsted
- Hydroxidionen: OH- + H+ → H2O
- Ammoniak: NH3 + H+ → NH4+
- Pyridin: C5H5N + H+ → C5H5NH+
- ...
Bei den Basen unterscheidet sich die Definition von Brønsted sehr erheblich von der nach Arrhenius, da bei Brønsted in jedem Fall die Aufnahme eines Protons als Charakteristikum einer Base angesehen wird und das Hydroxidion eigentlich keine Rolle mehr spielt. Diese Betrachtung hat in der Praxis Vor- und Nachteile:
Vorteilhaft ist, dass auch der Ammoniak und ähnliche Stoffe durch ihre Fähigkeit Protonen aufzunehmen als Base angesehen werden. Außerdem bildet nicht mehr länger jedes Metallhydroxid eine eigene Base. Alle Hydroxide sind Basen, weil Hydroxidionen gemäß der obigen Reaktionsgleichungen Protonen aufnehmen. Das für die basische Reaktion vollkommen unrelevante Kation spielt keine Rolle mehr.
Nachteilig ist, dass nicht ohne weiteres ersichtlich wird, wie es zu Bildung einer basischen Lösung kommt. Auf den ersten Blick sollte die obige Reaktion des Ammoniaks oder auch des Pyridins die Lösung nicht basisch werden lassen. Basische Lösungen enthalten einen Überschuss an Hydroxidionen aber in der Reaktionsgleichung werden keine gebildet - warum also ist eine wässrige Ammoniaklösung trotzdem basisch? Um das zu verstehen, reicht es nicht, die Reaktion als Base zu betrachten. Man muss sich mit den Säure-Base-Reaktionen, also den Protonenübertragungen, beschäftigen.
Säure-Base-Reaktionen nach Brønsted
Die Säure ist der Protonendonator - wer sich schon mal intensiver mit Physik beschäftigt hat, hat möglicherweise damit größere Probleme. Das einzelne, freie Proton hat aufgrund seiner sehr geringen Größe eine so hohe Ladungsdichte, dass seine Freisetzung viel mehr Energie erfordert, als in chemischen Reaktionen üblicherweise zur Verfügung steht. Es kann in chemischen Reaktionen also nicht freigesetzt werden. Der Protonendonator kann sein Proton normalerweise niemals einfach so abgeben. Die Protonenabgabe ist nur möglich, wenn es eine zweite Komponente gibt, die das Proton aufnimmt, sodass niemals ein freies Proton entstehen muss. Die Reaktion eines Stoffes als Brønsted-Säure kann nur erfolgen, wenn gleichzeitig ein anderer Stoff als Brønsted-Base reagiert und das Proton aufnimmt. Somit ist jede Reaktion nach Brønsted immer eine Säure-Base-Reaktion, eine Protonenübertragung!
Eine Säure-Base-Reaktion gemäß der Definition von Brønsted ist eine Protonenübertragung.
Die obigen Beispiele für Säuren und Basen können deshalb nur als Vereinfachung angesehen werden, bei der jeweils der Protonenakzeptor bzw. der -donator unterschlagen wurde. Tatsächlich müsste z.B. Wasser die jeweils fehlende Komponente darstellen, womit die obigen Beispiele wie folgt korrigiert werden müssen:
- Salzsäure: HCl + H2O → H3O+ + Cl-
- Schwefelsäure: H2SO4 + 2 H2O → 2 H3O+ + SO42-
- Phosphorsäure: H3PO4 + 3 H2O → 3 H3O+ + PO43-
- Salpetersäure: HNO3 + H2O → H3O+ + NO3-
- Flusssäure: HF + H2O → H3O+ + F-
- ...
Das Wasser reagiert in Gegenwart eines Protonendonators selbst unter Aufnahme eines Protons als Protonenakzeptor, also als Base. Dabei entsteht das Hydronium-Ion (H3O+) oder auch Oxoniumion.
- Hydroxidionen: OH- + H2O → H2O + OH-
- Ammoniak: NH3 + H2O → NH4+ + OH-
- Pyridin: C5H5N + H2O → C5H5NH+ + OH-
- ...
Mit einem Protonenakzeptor reagiert das Wassermolekül hingegen als Protonendonator, also als Säure, unter gleichzeitiger Bildung eines Hydroxidions. Hierdurch kann dann auch die Bildung einer basischen Lösung mit einem Überschuss an Hydroxidionen (OH-) verstanden werden.
Wasser ist ein Ampholyt, d.h. je nach Reaktionspartner kann es als Säure oder als Base reagieren. Es ist amphoter.
Säure-Base-Reaktionen als Gleichgewichte
Praktisch alle chemischen Reaktionen sind Gleichgewichtsreaktionen, die sich durch das Massenwirkungsgesetz auch mathematisch beschreiben lassen. Wendet man dieses Konzept auf einige der obigen Beispielreaktionen an, so findet man für die Hin- und auch die Rückreaktion je eine Säure und eine Base:
- Salzsäure: HCl + H2O ⇄ H3O+ + Cl- Säure Base Säure Base
- Schwefelsäure: H2SO4 + 2 H2O ⇄ 2 H3O+ + SO42- Säure Base Säure Base
- Phosphorsäure: H3PO4 + 3 H2O ⇄ 3 H3O+ + PO43- Säure Base Säure Base
- Ammoniak: NH3 + H2O ⇄ NH4+ + OH- Base Säure Säure Base
Die oben durch identische Farben gekennzeichneten Säure-Base-Paare, wie HCl/Cl-, H2O/OH-, H3O+/H2O ... bezeichnet man als korrespondierende oder auch konjugierte Säure-Base Paare. So ist Chlorid (Cl-) die konjugierte schwache Base zur starken Säure Chlorwasserstoff (HCl) und umgekehrt. Ammoniak (NH3) ist die konjugierte Base zur Säure Ammonium (NH4+) usw.
Neutralisation nach Brønsted
Der Begriff der Neutralisation ist in der Brønsted-Definition viel schwieriger zu definieren als bei Arrhenius. Durch die Begrenzung auf Vorgänge in wässrigen Lösungen ist bei Arrhenius völlig klar: Eine Neutralisation hat eine neutrale Lösung zur Folge, also pH=7. Auf dem Weg dorthin reagiert eine Säure mit einer Base, wodurch sich die beiden in ihrer Wirkung neutralisieren.
In der Definition von Brønsted ist das nun viel schwieriger, denn zum einen ist diese Definition nicht auf Wasser beschränkt und außerhalb des Wassers ist die "Neutralität" nicht definitiert weil der pH-Wert nicht definiert ist. Zum anderen ist jede Brønsted-Reaktion immer eine Reaktion einer Säure mit einer Base. Somit ist auch die Reaktion einer Säure mit einer Base nicht grundsätzlich eine Neutralisation.
Im Grunde bleibt somit nur der Verweis auf die Neutralisation nach Arrhenius Wenn eine Säure und eine Base sich in Ihrer Wirkung aufheben, sodass eine neutrale Lösung entsteht, spricht man von einer Neutralisation. Die Neutralisation ist dann bei Arrhenius und Brønsted im Grunde identisch.
Grenzen
Bei den Grenzen der Arrhenius-Definition wurden drei Beispiele aufgeführt, bei denen Arrhenius den falschen Stoff zur Säure bzw. Base erklärt. Die Definition von Brønsted löst das Problem für die Base Ammoniak. Die beiden Säuren aus den oben genannten Beispielen werden aber auch bei Brønsted noch falsch zugeordnet:
- Bortriflourid: BF3 + H2O ⇄ BF3OH- + H+ ?? Säure Base ??
- Aluminiumchlorid: AlCl3 + H2O ⇄ AlCl3OH- + H+ ?? Säure Base ??
In den beiden Beispielen wird in der Definition von Brønsted jeweils das Wassermolekül als Protonendonator zur Säure, während das Aluminiumchlorid (AlCl3) bzw. das Bortrifluorid (BF3) weder Säure noch Base sind. Tatsächlich erhält man aber eine saure Lösung, weil man Aluminiumchlorid bzw. Bortrifluorid in Wasser gibt - diese beiden Stoffe müssten demnach als Säure betrachtet werden. In der Definition von Brønsted gelingt das aber nicht.
Problematisch ist auch, dass das Proton (H+) selbst nicht als Säure definiert werden kann, obwohl es in den beiden Beispielen jeweils in der Rückreaktion mit dem Protonenakzeptor reagiert. So richtig schön ist das nicht.
Säure-Base-Definition nach Lewis
Die Definition von Brønsted lässt immer noch ein paar Lücken, die durch die Definition von Lewis gefüllt werden, allerdings nicht ohne Nachteile, wie wir bei den Grenzen der Definition sehen werden. Die Säure-Base-Definition von Lewis wird deshalb meistens parallel zu der von Brønsted verwendet, und zwar meistens nur dann, wenn die Definition von Brønsted nicht mehr ausreicht.
Die Definition
Betrachten wir noch mal die Reaktion des Bortrifluorids mit Wasser und ordnen zunächst die Begriffe Säure und Base anders zu: Der Stoff, der die Ursache für die saure Reaktion darstellt, das Bortrifluorid, wird die Säure und der Reaktionspartner, das Wasser, die Base. In der Rückreaktion muss das Proton die Säure darstellen und der Reaktionspartner entsprechend die Base sein. Damit ergibt sich die folgende Zuordnung:
- Bortriflourid: BF3 + H2O ⇄ BF3OH- + H+ Säure Base Base Säure
Betrachten wir die Reaktion detailliert in Strukturformeln, sieht man, was "wirklich" geschieht:
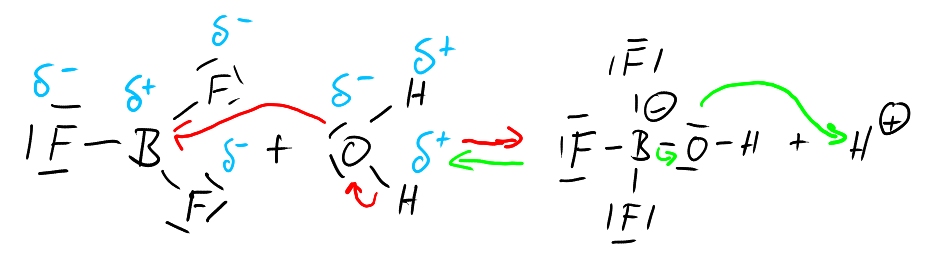
Das Boratom im Bortriflourid leidet unter starkem Elektronenmangel. Die Edelgaskonfiguration ist mit nur sechs Elektronen in den drei Bindungen zu den drei Fluoratomen nicht erreicht. Außerdem ist das Fluor dasjenige Atom mit der größeren Elektronegativität. Insgesamt entsteht so am Boratom ein so großer Elektronenmangel, dass das Boratom sehr leicht in der dargestellten Weise mit Atomen mit freien Elektronenpaaren reagiert. In Wasser kommt dabei nur das Sauerstoffatoms des Wassermoleküls in Frage.
In der Rückreaktion reagiert das Proton, dass ebenfalls einen großen Elektronenmangel besitzt ebenfalls mit einem freien Elektronenpaar.
Sowohl in der Hin- als auch der Rückreaktion reagiert das als "Säure" deklarierte Teilchen also mit einem freien Elektronenpaar und bildet mit diesem eine Elektronenpaarbindung aus. Das als Base bezeichnete Teilchen stellt das freie Elektronenpaar zur Verfügung. Diese Betrachtung führt unmittelbar zur Säure-Base-Definition von Lewis:
Eine Säure ist ein Elektronenpaarakzeptor.
Eine Base ist ein Elektronenpaardonator.
Auch in der Definition von Lewis gibt es demnach nur Säure-Base-Reaktionen. Es muss immer ein Elektronenpaar vom Akzeptor zum Donator "übertragen" werden. Die Einzelreaktion einer Säure ohne Base oder umgekehrt ist unmöglich. Es braucht immer Donator und Akzeptor.
Was schön ist...
Wirklich schön an der Lewis-Säure-Base-Definition ist, dass die Definition anders als die beiden anderen nicht an einzelnen Teilchensorten festgemacht ist, sondern an der Reaktionsweise. Ursächliche für die ätzende Wirkung einer Säure ist der Elektronenmangel des "sauren" Teilchens. Genau das macht die Lewis-Definition zu ihrer Grundlage. Warum das Teilchen einen Elektronenmangel aufweiset oder welches Teilchen es ist, spielt keine Rolle. Es geht einzig um die Reaktion als Elektronenpaarakzeptor. Dadurch werden alle ähnlichen Reaktionen unabhängig von der Art der beteiligten Teilchen zu Säure-Base-Reaktionen.
... und was nicht so schön ist...
Nicht so schön an der Lewis-Definition ist, dass die Protonendonatoren nach Brønsted alle keine Säuren mehr sind. Die Säure ist hier in jedem Fall das Teilchen mit dem Elektronenmangel, also das Proton. Schwefelsäure, Salzsäure, Phosphorsäure,.... heißen dann alle zu Unrecht "Säure" denn sie setzen ja nur das als Lewis-Säure reagierende Proton frei, ohne jedoch selbst die Lewis-Säure zu sein.
Fazit
Keine der obigen Säure-Base-Definitionen ist wirklich umfassend und gleichzeitig einfach und jederzeit praktikabel. Irgendwie haben sie alle Vor- und Nachteile. In der Praxis wird der Begriff der Säure oder Base in der Folge etwas schlampig verwendet - man benutzt diejenige Definition, die gerade am schönsten zum eigenen Formulierungswunsch passt - und warum auch nicht? Wenn es erforderlich ist, spricht man explizit von einer Lewis-Säure oder einer Brønsted-Säure und wenn man nur "Säure" sagt, wird man aber üblicherweise trotzdem verstanden. Keine der drei Definitionen ist richtig oder falsch und man kann immer diejenige benutzen, die gerade am besten zum eigenen Formulierungsproblem passt.
