Moleküle im Schalenmodell
Eine ziemlich fundamentale Erkenntnis in der Chemie, die auch schon im im Text zu Atome im Schalenmodell beschreiben wurde, besagt:
Ein Atom, dass durch Elektronenabgabe oder -aufnahme die gleiche Elektronenverteilung wie das ihm im Periodensystem am nächsten stehende Edelgas erreicht hat, befindet sich in einem besonders stabilen Zustand.
Das ist also der Antrieb für die Ausbildung von Verbindungen: Die an der Verbindung beteiligten Atome geben Elektronen ab oder nehmen welche auf, sodass am Ende alle beteiligten Atome die Edelgaskonfiguration erreicht haben - eigentlich ganz einfach. Diese "einfache" Elektronenabgabe oder -aufnahme führt zur Bildung von Ionen und dann zur Bildung von Salzen, in denen die Ionen durch eine Ionenbindung zusammen gehalten werden. Solche Salze bilden sich immer dann, wenn ein Metall mit einem Nichtmetall reagiert. Das Metallatom gibt dann Elektronen an das Nichtmetallatom ab. Nichtmetallatome wie Sauerstoff, Stickstoff, Wasserstoff, Kohlenstoff,... nehmen also in der Regel Elektronen auf und werden dadurch zu den entsprechenden Anionen.
Was passiert aber, wenn an der Reaktion kein Metallatom teilnimmt, wenn also nur Nichtmetallatome vorhanden sind. Wie erreichen dann die beteiligten Atome die Edelgaskonfiguration? Die Antwort ist etwas schwieriger, denn so richtig vollkommen können sie die Edelgaskonfiguration in so einem Fall nicht erreichen. Sie können sich aber dem "perfekten Zustand" möglichst weit annähern, in dem sie Moleküle bilden und sich dabei Elektronen teilen. Diese Molekülbildung wird im Folgenden genauer beschreiben.
Ein Molekül ist ein kleines Teilchen aus relativ wenigen, fest miteinander verbunden Atomen. Zwischen zwei Molekülen bestehen nur schwache Anziehungskräfte. Die meisten Moleküle enthalten keine Metallatome.
Moleküle aus lauter gleichen Atomen - die Elemente
Wasserstoff und Halogene

Betrachtet man Wasserstoff im Schalenmodell und vergleicht die Darstellung mit der des im Periodensystem am nächsten stehenden Edelgases, des Heliums, fällt sofort auf, dass sich die Atomhüllen der beiden Atome nur durch ein Elektron unterscheiden. Zur Elektronenkonfiguration des Heliums fehlt dem Wasserstoff ein Elektron.
Das gleiche Ergebnis liefert der Vergleich des Fluors mit dem Neon, das dem Fluor am nächsten stehende Edelgas. Auch hier unterscheiden sich die Atomhüllen nur um ein Elektron, dass das Edelgas mehr besitzt. In der gleichen Weise könnte man nun alle Elemente der 7. Hauptgruppe mit den jeweils im Periodensystem benachbarten Edelgasen vergleichen. Das Ergebnis wäre immer das Gleiche: Den Elementen der 7. Hauptgruppe fehlt ein Elektron zur Edelgaskonfiguration.
Sperrt man nun ganz viele Wasserstoffatome gemeinsam in eine Gasflasche, fehlt jedem dieser Atome ein Elektron und weit und breit ist kein Atom sichtbar, dass eventuell bereit wäre diesem Mangel abzuhelfen - ach je. Eine Lösung muss her. Das kann so nicht bleiben......
Ich stelle mir mal folgendes vor: Ich bin ein Wasserstoffatom und ich WILL noch ein zweites Elektron, unbedingt, um jeden Preis!!! Und rund um mich rum gibt es nur andere Wasserstoffatome, denen es genau so geht. Also verbinde ich mich mit einem dieser anderen Wasserstoffatome und wir schließen folgenden Deal: Ich gebe Dir von meinem Elektron ab, wenn Du mir von Deinem gibst. Und da diese Art der Bindung ohne Alternativen ist - das "geliehene" Elektron oder keines - lässt sich mein Partner natürlich darauf ein. In der Folge "leihe" ich ihm mein Elektron so lange er mir seines "leiht". Wir schließen also unsere äußeren Schalen so zusammen, dass sich unsere beiden Elektronen in dieser gemeinsamen Schalen befinden.

Wie man in der Abbildung zum "Wasserstoffmolekül im Schalenmodell" sieht, sind die beiden Wasserstoffatome nun durch die überlappenden äußeren Schalen mit den im Überlappungsbereich befindlichen Elektronen fest miteinander verbunden. Diese beiden Wasserstoffatome bilden ein Wasserstoffmolekül, bei dem jedes der beiden Atome zwei Elektronen zu seiner Verfügung hat, wenngleich ihm nur eines wirklich gehört. Durch die gemeinsame Nutzung dieses Elektronenpaars im Überlappungsbereich kommt somit jedes der beiden Atome der Edelgaskonfiguration des Heliums so nahe, wie es in der Situation möglich ist.
Elemente der 6. Hauptgruppe

Alle Atome der sechsten Hauptgruppe haben sechs Elektronen auf der äußersten besetzten Schale. Das im Periodensystem am nächsten stehende Edelgas hat jeweils acht Elektronen in der äußersten besetzten Schale. Zur Edelgaskonfiguration fehlen den Atomen der sechsten Hauptgruppe also zwei Elektronen. Ein Atom der sechsten Hauptgruppe hat daher zwei Möglichkeiten die Edelgaskonfiguration zu erreichen:
- Das Atome sucht sich ein anderes Atom und leiht diesem zwei Elektronen und bekommt im Gegenzug zwei zurück, sodass sich die beiden Atome insgesamt vier Elektronen buw. zwei Elektronenpaare teilen.
- Das Atom sucht sich zwei andere Atome und leiht jedem von ihnen ein Elektron und bekommt im Gegenzug je eines zurück. Das Atom wäre dann mit zwei anderen Atomen über jeweils zwei Elektronen bzw. jeweils ein Elektronenpaar verbunden.
Tatsächlich findet man bei den Elementen der sechsten Hauptgruppe beide Strategien mit unterschiedlichen Folgen für die äußere Erscheinungsform des Stoffes.
Sauerstoff - das kleinste Atom der Gruppe

Auf der Suche nach der Edelgaskonfiguration wählt der Sauerstoff den ersten der beiden oben beschriebenen Wege. Ein Sauerstoffatom verbindet sich mit einem anderen, indem sich die beiden Sauerstoffatom insgesamt vier Elektronen teilen, zwei von jedem der beiden Bindungspartner. Hierdurch entsteht ein Sauerstoffmolekül (O2) aus genau zwei fest miteinander verbundenen Atomen, wobei die Bindung durch zwei Elektronenpaare bzw. vier Elektronen erfolgt. Hierdurch hat jedes der beiden Sauerstoffatome acht Elektronen zur Verfügung: Vier eigene und vier geteilte.
Das Problem mit der Leibesfülle: die anderen Atome
Bei den weiter unten in der 6. Hauptgruppe stehenden Nicht- und Halbmetallen (Schwefel, Selen, Tellur) gelingt die Ausbildung von zweiatomigen Molekülen mit vier gemeinsamen Elektronen zwischen zwei Atomen nicht mehr. Diese Elemente wählen von den beiden oben beschriebenen Wegen zur Edelgaskonfiguration den zweiten: Jedes Atom verbindet sich mit zwei anderen über je ein Elektronenpaar.

Exemplarisch ist dies für den Schwefel in der Abbildung gezeigt. Zwei Schwefelatome sind durch ein bindendes Elektronenpaar miteinander verbunden. Da nun aber jedes Schwefelatom mit zwei anderen Schwefelatomen verbunden ist, kann kein zweiatomiges Molekül mehr entstehen. Stattdessen entstehen größere Moleküle aus relativ vielen Atomen. Beim Schwefel ist die Situation noch am Einfachsten: Schwefelmoleküle bestehen aus acht Schwefelatomen (S8), die in einem Ring verbunden sind. Bei Selen und Tellur gibt es mehrere unterschiedliche Varianten - ich erspare Dir die Details...
Der Grund für die Unfähigkeit der größeren Atome zweiatomige Moleküle mit zwei bindenden Elektronenpaaren zwischen den beiden Atomen zu bilden, hängt mit der Größe der Atome zusammen. Für eine relativ exakte Erklärung musst Du Dich mit dem Orbitalmodell und der Hybridisierung befassen. Da Du diesen Text aber bis hierhin gelesen hast, nehme ich an, dass das Orbitalmodell Dir noch unbekannt ist - deshalb versuche ich es mal mit einer einfachen Modellerklärung, wenn auch einer falschen. Aber dieses Problem haben ja alle Erklärungen mit anschaulichen Modellen.
Möglicherweise kennt Du "Bernd das Brot"? Sonst stell Dir einfach einen kastenförmigen Körper ohne arme aber mit zwei Händen vor. Wenn der Körper nun relativ schlank ist, so wie bei den relativ kleinen Sauerstoffatomen, dann können sich zwei dieser Brote einander gegenüberstellen und sich beide Hände reichen. Die beiden Brote wären dann durch zwei Handpaare bzw. vier Hände miteinander verbunden. Wenn das Brot aber eher etwas dicklich ist, wie die Atome Selen oder Tellur, dann könnten sich die zwei einander gegenüber stehenden Brote nur noch je eine Hand reichen, weil durch die fehlenden Armen der Körper einfach im Weg wäre. In diesem Fall haben die Atome also keine andere Wahl, als sich mit zwei anderen Atomen zu verbinden, weil sie einfach keine zwei Bindungen in die gleiche Richtung, also zum gleichen Bindungspartner, ausbilden können.
Elemente der 5. Hauptgruppe

In der fünften Hauptgruppe gibt es nur zwei Nichtmetalle - Stickstoff und Phosphor. Vergleicht man diese beiden Elemente mit dem im Periodensystem am nächsten stehenden Edelgasen, sieht man dass den Atomen der Elemente der 5. Hauptgruppe drei Elektronen zum Erreichen der Edelgaskonfiguration fehlen. Stickstoff und auch Phosphor müssen also drei Bindungen ausbilden, d.h. drei eigene Elektronen "verleihen" um im Gegenzug drei fremde Elektronen "geliehen" zu bekommen.
Für das Stickstoffmolekül (N2) bedeutet dies, dass zwei Stickstoffatome sich insgesamt sechs Elektronen bzw. drei Elektronenpaare teilen. Von diesem sechs gemeinsamen Elektronen stammen drei von jedem der beiden Stickstoffatome. Jedes Stickstoffatom hat noch zwei "eigene" Elektronen, d.h. ein "freies Elektronenpaar" und nutzt die sechs bindenden Elektronen. Dadurch stehen jedem Stickstoffatom auf seiner äußersten Schale acht Elektronen zur Verfügung.

Für das Phosphoratom gilt das Gleiche, wie oben bereits für Schwefel, Selen und Tellur: Der Phosphor kann wegen seiner Größe immer nur eine Bindung aus zwei Elektronen zu jedem Bindungspartner ausbilden. Aus diesem Grund kann es kein zweiatomiges Phosphormolekül geben. Stattdessen muss sich jedes Phosphoratom im Phosphormolekül mit drei anderen Phosphoratomen verbinden, die ihrerseits auch wieder mit drei anderen Phosphoratomen verbunden sein müssen usw.
Das klingt jetzt so, als müsste das Phosphormolekül riesig groß sein. Tatsächlich gibt es verschiedene Varianten des Phosphors und für einige stimmt das tatsächlich. Es entstehen riesengroße Moleküle, in denen jedes Phosphoratom immer mit drei anderen verbunden ist. Es gibt allerdings eine Phosphorvariante, in der die Moleküle klein sind; genauer: immer aus genau vier Phosphoratomen bestehen (P4). Diese vier Phosphoratome sind dabei in Form einer dreieckigen Pyramide angeordnet, wobei jedes Atom mit jedem der drei Anderen verbunden ist. Dieses 3-dimensionale Molekül lässt sich aber kaum noch als Schalenmodell-Darstellung auf einen 2-dimensionalen Monitor zeichnen, also erspare ich Dir und mir den Versuch.
Elemente der 4. Hauptgruppe

Vergleicht man die Elemente der vierten Hauptgruppe mit dem im Periodensystem am nächsten stehenden Edelgas hat man zunächst ein Problem: Welches ist das nächste Edelgas? In der äußersten Schale des Kohlenstoffs sind vier Elektronen mehr als beim Helium und vier weniger als beim Neon. Welches ist also zu wählen?
Wir betrachten hier nur die Ausbildung von Molekülen und nicht die von Salzen aus Ionen. Bei der Bildung eines Moleküls werden immer Bindungen durch die gemeinsame Nutzung von Elektronenpaaren geknüpft. Hierbei besteht jedes Elektronenpaar immer aus je einem Elektron von jedem der beiden Atome und steht danach beiden an der Bindung beteiligten Atomen zur Verfügung. Durch die Ausbildung einer solchen Bindung nimmt die Zahl der verfügbaren Elektronen auf der äußersten Schale also immer zu, d.h. es wird immer die Elektronenkonfiguration des Edelgases mit der höheren Elektronenzahl angestrebt. DAS Kohlenstoffatom wird also versuchen, die Elektronenkonfiguration des Neons zu erreichen.
Jedes Kohlenstoffatom muss also im "Kohlenstoffmolekül" vier Bindungen aus je einem Elektronenpaar zu anderen Kohlenstoffatomen ausbilden. Aus geometrischen Gründen ist hier nun auch bei einem so kleinen Atom ein zweiatomiges Molekül nicht mehr möglich, d.h. die insgesamt vier bindenden Elektronenpaare können NICHT nur genau zwei Atome miteinander verbinden. Das "Kohlenstoffmolekül" besteht also aus mehr als zwei Atomen - von den Fullerenen abgesehen besteht das "Kohlenstoffmolekül aus gigantisch vielen Atomen. Die Fullerene lassen wir hier mal außen vor und beschäftigen uns mit den beiden bekannteren Erscheinungsformen des Kohlenstoffs: Graphit und Diamant.
Graphit


Im Graphit, den Du z.B. von Deiner Bleistiftmine kennst, verbindet sich jedes Kohlenstoffatom immer mit drei anderen Kohlenstoffatomen. Zwei dieser Bindungen bestehen aus nur einem bindenden Elektronenpaar, die Dritte hingegen aus zwei. Hierdurch stehen jedem Kohlenstoffatom auf seiner äußersten Schale acht Elektronen zur Verfügung: Vier eigene und vier "geliehene". Alle Elektronen der äußersten Schale des Kohlenstoffs sind an der Bindungsbildung beteiligt, sodass keine freien Elektronenpaare mehr übrig sind.
Das besondere an der Graphitstruktur ist, dass sie nur aus Sechsecken besteht. Ein "Graphitmolekül" ist ein gigantisch großes, zweidimensionales Gebilde aus lauter Sechsecken. In einem Graphitklumpen werden nun viele dieser Schichten übereinander gestapelt. Die Schicht, also das "Molekül", ist sehr stabil aber zwischen zwei Schichten besteht keinerlei Verbindung. Es gibt nur ganz schwache Anziehungskräfte. Wenn Du nun mit einem Graphitklumpen wie der Bleistiftmine über ein Blatt Papier reibst, reiben sich die einzelnen Moleküle sehr leicht vom Klumpen ab und bleiben am Papier hängen - Du hast eine Linie auf das Blatt gemalt. Allerdings haften diese Schichtmoleküle auch nur relativ lose am Papier, sodass Du sie mit einem Stück weichen Gummis einfach wieder abrubbeln kannst - wegradieren sozusagen.
Diamant

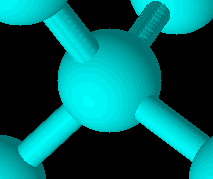
Im Diamant bildet jedes Kohlenstoffatom genau vier Bindungen zu genau vier anderen Kohlenstoffatomen aus, die ihrerseits wieder mit vier Kohlenstoffatomen verbunden sind usw. Jede Bindung wird durch genau zwei Elektronen, also ein Elektronenpaar gebildet. Wie auch beim Graphit werden alle Elektronen der äußersten Schale des Kohlenstoffs für die Bindungsbildung benötigt. Anders als beim Graphit ist das entstehende Molekül aber nicht "platt" (planar, zweidimensional), sondern dreidimensional. Es bilden sich also keine schichtartig stapelbaren Moleküle. Stattdessen ist ein Diamant ein dreidimensionaler Kristall, bei dem jedes Kohlenstoffatom "tetraedrisch" von seinen vier Bindungspartnern umgeben ist. Ein Tetraeder ist eine dreieckige Pyramide. Die vier Bindungspartner eines Kohlenstoffatoms bilden also eine solche Pyramide, in deren räumlichen Zentrum sich das Kohlenstoffatom befindet, mit dem alle "Eckenatome" verbunden sind. Da diese Anordnung für alle Atome des Moleküls gilt, bildet sich eine extrem feste Struktur aus, von der man kaum je etwas abreiben kann - Diamant ist die härteste Substanz, die wir kennen.
Silicium
Das zweite Element der 4. Hauptgruppe, dass in nennenswerter Weise Moleküle bildet, ist das Silicium. Wie schon bei den zuvor betrachten Hautgruppen, kann das relativ große Siliciumatom keine "Doppelbindungen" ausbilden. Jedes Siliciumatom verbindet sich also immer mit vier anderen Siliciumatomen. Eine Grahit-ähnliche Struktur ist nicht möglich. Siliciumatome sind im Silicium immer so angeordnet, wie Kohlenstoffatome im Diamant. Das hat viele spannende Konsequenzen für die elektrischen Eigenschaften des Siliciums, weshalb Silicium die Basis der aktuellen Halbleitertechnik bildet, aber das wäre ein zu tiefer Exkurs in die Physik...... Deshalb soll das hier zum Silicium erst mal reichen.
Nichtmetalle der 3. Hauptgruppe - das Bor

In der dritten Hauptgruppe gibt es nur ein Nichtmetall: Bor. Die anderen Elemente der dritten Hauptgruppe sind Metalle und bilden eigentlich immer Ionen. Bor ist in dieser Gruppe das einzige Element, dass klassische Moleküle bilden könnte und gleichzeitig ist es auch eines der mysteriösesten Elemente überhaupt. Betrachtet man die Elektronenverteilung des Bors und vergleicht sie mit der der nächstgelegenen Edelgase Helium und Neon, fällt folgendes Problem auf:
Das Problem
Bor hat drei Elektronen auf der äußersten Schale und somit also drei Elektronen mehr, als das Edelgas Helium und fünf Elektronen weniger als das Edelgas Neon. Das im Periodensystem am nächsten stehende Edelgas wäre also das Helium. Aber durch die Bildung von Molekülen kann die Zahl der auf der äußersten Schale verfügbaren Elektronen nur größer werden, da ja die vom Bindungspartner geliehenen Elektronen dazu kommen. Die Edelgaskonfiguration des Heliums ist für das Bor also in Molekülen (und auch sonst) unerreichbar.

Leider gilt das Gleiche auch für die Elektronenkonfiguration des Neons. Bor hat drei eigene Elektronen auf der äußersten Schale, die es "verleihen" könnte. Im Gegenzug bekäme es drei fremde Elektronen zurück "geliehen", was zusammen aber nur sechs Elektronen wären. In der Abbildung zum hypothetischen B2-Molekül sieht man: Jedes der beiden Boratome in diesem Molekül hätte nur sechs Elektronen auf seiner äußersten Schale zur Verfügung, weshalb es dieses Molekül nicht geben kann. Auch die Elektronenkonfiguration des Neons ist also für das Bor unerreichbar.
Es ist also vollkommen unmöglich, dass das Nichtmetall Bor ein Molekül bildet und dabei die Edelgaskonfiguration erreicht. Bor bildet aber trotzdem Moleküle... der Natur ist offenbar egal, wenn unsere Regeln nicht auf sie passen wollen.
Die Extrawurst nur fürs Bor

Im obigen "hypothetischen B2-Molekül fehlen jedem der beiden Boratome noch zwei Elektronen, weshalb es das B2-Molekül nicht gibt. Stattdessen bilden sich größere Moleküle, bei denen die Boratome in einer räumlichen Struktur so miteinander verbunden sind, dass jedes Boratom mit drei anderen Boratomen eine Bindung durch je ein Elektronenpaar ausbildet. Natürlich wird auch so die Edelgaskonfiguration nicht erreicht, denn es sind ja immer noch nur drei Bindungen an jedem Boratom und damit auch nur sechs Elektronen. Aber: In dieser Struktur ist es möglich, dass ein Boratom einer Bindung zwischen zwei anderen Atomen sehr nahe kommt. Hierdurch kann das dritte Boratom mit seiner noch nicht ausreichend gefüllten äußersten Schale ebenfalls diese zwei Elektronen der Bindung zwischen den beiden anderen Boratomen mit nutzen, ohne dass es eigene Elektronen dazu geben müsste. Es bildet sich eine "zwei Elektronen Dreizentren"-Bindung aus, bei der drei Boratome sich zwei Elektronen teilen. Zwei der drei Atome gaben ein Elektron in die Bindung. Das dritte Atom ist quasi ein Schnorrer ohne eigenen Beitrag zur Bindung. Am Ende erreichen im elementarem Bor auf die Art alle Boratome eine Elektronenkonfiguration, die der des Neons so nahe wie möglich kommt. Meines Wissens gibt es diese Art der Bindung nur beim Bor.
Moleküle aus verschiedenen Atomen - Verbindungen
Außerhalb der Luft mit Stickstoff (N2) und Sauerstoff (O2) findet man die Nichtmetalle des Periodensystems nur selten in elementarer Form. Weit häufiger kommen sich in Form von Verbindungen vor. Zwar gibt es Vorkommen für elementaren Schwefel (S8) oder Graphit (Kohle) aber beim intensiven Blick in Deine Umgebung wirst Du die meisten Nichtmetalle nur in Verbindungen finden.
In diesen Verbindungen sind mehrere Nichtmetallatome so miteinander verbunden, dass jedes von ihnen der Edelgaskonfiguration maximal nahe kommt. Außerdem kommen relativ häufig noch Elektronen von irgendeinem Matallatom dazu, sodass sich Molekülionen bilden, wie etwa Sulfat (SO42-), Carbonat (CO32-), Phosphat (PO43-) oder Nitrat (NO3-).
Kohlenstoffdioxid - CO2
Nicht erst seit dem Klimawandel ist dieses Molekül in aller Munde - schon immer atmen wir es aus und Pflanzen benötigen es zum Wachstum. Für das Leben auf der Erde ist das Kohlendioxidmolekül sicherlich eines der wichtigsten Moleküle. Gucken wir es uns mal genauer an:

CO2 bedeutet, dass in in dem Molekül ein Kohlenstoffatom und zwei Sauerstoffatome vorkommen. Kohlenstoff hat vier Elektronen in der äußersten Schale und jedes der beiden Sauerstoffatome sechs. Insgesamt stehen also auf allen äußeren Schalen zusammen 4+2·6=16 Elektronen zur Verfügung, die so verteilt werden müssen, dass jedes Atom über acht Elektronen auf seiner äußersten Schale verfügt.
Das Kohlenstoffatom mit seinen vier Elektronen auf der äußersten Schale muss dabei vier Bindungen ausbilden, um auf acht Elektronen auf der äußersten Schale zu kommen. Jedem der beiden Sauerstoffatome reichen hingegen zwei Bindungen. Die einzige sinnvolle Möglichkeit ist, dass das Kohlenstoffatom mit jedem der beiden Sauerstoffatome zwei Bindungen ausbildet, sich also mit jedem der Sauerstoffatome zwei Elektronenpaare bzw. vier Elektronen teilt.

Auf diese Weise stehen jedem der drei Atome acht Elektronen auf seiner äußersten Schale zur Verfügung. Das Kohlenstoffatom musste, so wie immer, alle seine vier Elektronen zur Bildung von Bindungen nutzen, während die beiden Sauerstoffatome nur jeweils zwei ihrer sechs Elektronen zur Bindungsbildung nutzen mussten. Den beiden Sauerstoffatomen stehen deshalb neben den beiden bindenden Elektronenpaaren zum Kohlenstoff noch je zwei freie Elektronenpaare zur Verfügung.
Wasser - H2O
Das Wassermolekül ist für die Entstehung des Lebens ebenfalls unverzichtbar und in unserer Umgebung allgegenwärtig. Betrachten wir es also etwas genauer: H2O bedeutet, jedes Wassermolekül besteht aus genau zwei Waserstoffatomen und einem Sauerstoffatom.

Jedes der beiden Wasserstoffatome hat ein Elektron auf der äußersten Schale und bräuchte bis zur Erreichung der Edelgaskonfiguration des Heliums noch ein weiteres Elektron. Das Sauerstoffatom hat immer noch sechs Elektronen auf der äußersten Schale und muss also zwei Bindungen ausbilden, während jedes der beiden Wasserstoffatome jeweils eine Bindung eingeht.
Wie schon im CO2 und im O2 und auch in beinahe allen anderen Molekülen geht das Sauerstoffatom mit zwei seiner Elektronen zwei Bindungen ein und verfügt dann noch über zwei freie Elektronenpaare. Das Sauerstoffatom erreicht so im Wasser acht Elektronen auf seiner äußersten Schale und damit die Elektronenkonfiguration des Edelgases Neon (Ne). Die beiden Wasserstoffatome haben jeweils zwei Elektronen auf ihrer äußersten Schale zu Verfügung und erreichen dadurch die Elektronenkonfiguration des Edelgases Helium
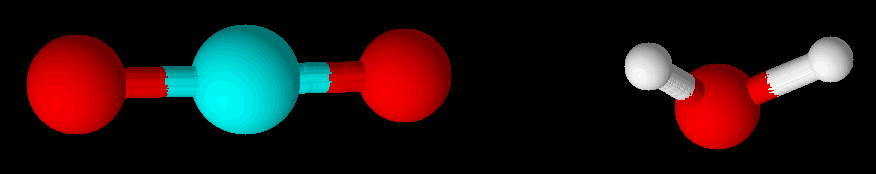
CO2 und H2O - Vergleich in 3D
Vergleicht man das Wassermolekül mit dem Kohlenstoffdioxidmolekül, gibt es viele Unterschiede und einige Gemeinsamkeiten. Beide Moleküle bestehen aus drei Atomen, die scheinbar in Form einer Kette miteinander verbunden sind. Allerdings hat beim Wassermolekül das Atom in der Mitte zwei freie Elektronenpaare bzw. vier nicht an Bindungen beteiligte Elektronen. Somit findet man beim Wassermolekül vier voneinander unabhängige Elektronenpaare am mittleren Atom.
Beim Kohlenstoffdioxidmolekül findet man hingegen am mittleren Atom nur bindende Elektronenpaare, die die insgesamt nur zwei Bindungspartner binden. Im CO2 gibt es am mittleren Atom ebenfalls vier Elektronenpaare, die aber nicht unabhängig sind. Stattdessen müssen immer zwei dieser Elektronenpaare in die gleiche Richtung orientiert sein, um die Bindung bilden zu können.
Dieser kleine Unterschied hat weitreichende Folgen für die räumliche Struktur der beiden Moleküle und in der Folge für die physikalischen Eigenschaften der beiden Stoffe.
Da Elektronen negativ geladen sind und gleiche Ladungen sich abstoßen, stoßen sich Elektronen gegenseitig ab und sind deshalb i.d.R möglichst weit auseinander. Gleichzeitig sind Elektronen auf voll besetzten Schalen aus quantenmechanischen Gründen immer paarweise im gleichen Raum organisiert, weshalb oben immer wieder von Elektronenpaaren gesprochen wurde.
Im Wassermolekül besitzt das mittlere Atom vier voneinander unabhängige Elektronenpaare, die wegen der gegenseitigen Abstoßung so weit wie möglich voneinander entfernt sind. Deshalb zeigt das Wassermolekül in der 3-dimensionalen Darstellung eine gewinkelte Form.
Im Kohlenstoffdioxid besitzt das mittlere Atom ebenfalls vier Elektronenpaare, von denen aber immer zwei zum gleichen Nachbaratom gerichtet sein müssen, um die Bindung auszubilden. Es gibt also nur zwei voneinander unabhängige Gruppen von Elektronen, zwischen denen sich ein maximaler Abstand einstellt. Deshalb befinden sich die beiden Sauerstoffatome im Kohlenstoffdioxidmolekül auf genau gegenüberliegenden Seiten des zentralen Kohlenstoffatoms und das Kohlenstoffdioxidmolekül ist linear.
Die Folge dieser unterschiedlichen Geometrie ist u.a, dass Wasser bei Raumtemperatur flüssig und Kohlenstoffdioxid gasförmig ist. Außerdem kann Wasser fest, flüssig oder gasförmig sein, während Kohlenstoffdioxid bei -78°C direkt vom festen in den gasförmigen Zustand wechselt und bei "Normaldruck" nicht flüssig werden kann.
Methan - CH4
Methan (CH4) ist in den letzten Jahren immer wieder in den Medien gewesen, weil es zum Klimawandel beiträgt und aus den Därmen von Kühen durch die hintere Öffnung entweicht. Diejenigen von uns, die wenig Rindfleisch essen, konnten damit also den Rindfleischessern die Schuld am Treibhauseffekt zuschieben und so von ihrer eigenen Schuld ablenken - ein allgemein beliebtes Vorgehen. Nebenbei und weitgehend unbemerkt ist Methan aber auch der Hauptbestandteil von Erdgas und von Biogas. Es entweicht nicht nur aus den Innereien von Rindern sondern auch menschliche Pubse enthalten Methan.... Es ist also sozusagen allgegenwärtig.

Das Methanmolekül besteht aus einem Kohlenstoffatom und vier Wasserstoffatomen. Kohlenstoff besitzt vier Elektronen auf der äußersten Schale (s.o.) und braucht acht, um die Elektronenkonfiguration des nächsten Edelgases, des Neons, zu erreichen. Kohlenstoff muss also vier Bindungen ausbilden, eine mit jedem seiner vier Elektronen. Das Kohlenstoffatom hat dann im Methanmolekül durch vier bindende Elektronenpaare die Edelgaskonfiguration des Neons erreicht.
Wasserstoff hat überhaupt nur ein Elektron und braucht ein Zweites, um die Elektronenkonfiguration des Heliums, des am nächsten stehenden Edelgases zu erreichen. Deshalb bildet Wasserstoff in Molekülen mit seinem einzigen Elektron immer genau eine Bindung aus.
Im Methanmolekül befindet sich also der Kohlenstoff in der Mitte und ist von den vier, durch jeweils ein Elektronenpaar gebundenen Wasserstoffatomen umgeben.
