Die Brennstoffzelle
Was machen Brennstoffzellen?
Brennstoffzellen sind im Grunde nichts anderes als Batterien. Allerdings haben sie gegenüber gewöhnlichen Batterien einige Vorteile, wie Du im Folgenden sehen wirst.
Eigentlich sind Brennstoffzellen, anders als Batterien, keine Energiespeicher, sondern Energiewandler. Eine klassische Batterie oder ein Akku speichert Energie und setzen sie auf Wunsch wieder frei. Bei der Brennstoffzelle sind diese beiden Aufgaben getrennt. Der Brennstoff, z.B. Wasserstoff, ist der Energiespeicher, der in einem separaten Tank gelagert wird und die eigentliche Brennstoffzelle ist der Energiewandler, der die gespeicherte Energie in Form von elektrischer Energie verfügbar macht.
Also wie überall so gilt auch hier: Energie kann nicht aus dem "Nichts" erzeugt werden und Brennstoffzellen sind nicht der Ausweg aus allen unseren Energieproblemen, sondern nur ein Teil eines Energiespeichers. Trotzdem können Brennstoffzellen helfen, die Energie aus Sonne und Wind, die ja nicht zu jeder Zeit verfügbar ist, technisch besser nutzbar zu machen und so dazu beitragen unser "Energieproblem" zu verringern.
Brennstoffzellen mit Wasserstoff
Funktionsweise einer Wasserstoffbrennstoffzelle
Wasserstoff kann zum Betrieb von Brennstoffzellen genutzt werden. Der benötigte Wasserstoff kann entweder durch Spaltung von Wasser in Wasserstoff und Sauerstoff durch elektrischen Strom (durch eine sog. Elektrolyse) oder aus Gas oder Öl durch thermische Umwandlung gewonnen werden. Was dabei im Detail passiert und wie es etwa funktioniert ist z.B bei Wikipedia beschrieben und soll hier nicht noch einmal erläutert werden. Für alle Verfahren gilt: Aus dem Wasserstoff kann in der Brennstoffzelle immer nur weniger Energie gewonnen werden, als vorher in dessen Herstellung investiert werden musste (inklusive der im fossilen Energieträger gespeicherten Energie). Ein Teil der Energie geht also verloren.
In der Brennstoffzelle findet eine sogenannte kalte chemische Verbrennung statt, bei der aus dem Wasserstoff durch Reaktion mit Sauerstoff (entweder aus der Luft oder aus einem separaten Tank) Wasser wird. Die hierbei frei werdende chemische Energie kann in Form von elektrischer Energie nutzbar gemacht werden. Der Weg hierzu ist allerdings komplizierter, als es sich zunächst anhört. Damit die Verbrennung tatsächlich eine kontrollierbare kalte Verbrennnung ist, dürfen Wasserstoff und Sauerstoff nicht einfach vermischt und gezündet werden. Vielmehr muss die Umsetzung des Wasserstoffs an anderer Stelle passieren als die des Sauerstoffs und die Produkte dieser getrennten Umsetzungen werden erst hiernach zusammengeführt, um das Wasser entstehen zu lassen. Die Energie muss allerdings vom Wasserstoff schon durch die beiden räumlich getrennten Einzelreaktionen bereitgestellt werden.
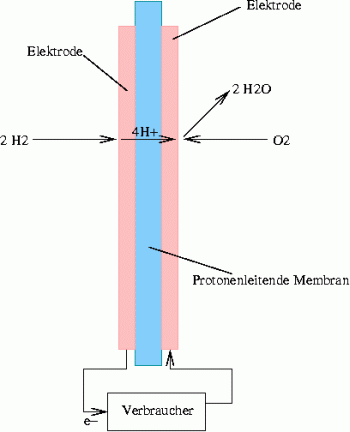
Die Abbildung auf dieser Seite zeigt den schematischen Aufbau einer Brennstoffzelle. Von der linken Seite strömt molekularer Wasserstoff (H2) auf die Elektrode (Anode) und wird dort oxidiert. Während nun die Elektronen (e-) den Weg über die Leitungen durch den Verbraucher nehmen und dort die Energie zur Verfügung stellen, die bei der Oxidation von Wasserstoff durch Sauerstoff zu Wasser frei wird, müssen die zurück bleibenden Protonen (H+) auf irgendeine Weise die protonenleitende Membran durchqueren. Auf der anderen Seite, an der anderen Elektrode (Kathode), wird der molekulare Sauerstoff (O2) an der Elektrode zu Oxidionen (O2-) umgesetzt, wobei der Elektrode Elektronen entzogen werden. Diese Oxidionen reagieren nun mit den durch die Membran gewanderten Protonen zu Wasser. Als Bruttoreaktion ergibt sich also:
2 H2 + O2 -> 2 H2O
Diese, in der Brennstoffzelle ablaufende Reaktion, entspricht demnach genau der Verbrennung von Wassertoff, weshalb man auch von einer kalten Verbrennung spricht, denn unter optimalen Bedingungen wird der größte Teil der frei werdenden Energie nicht in Wärme sondern in nutzbare elektrische Energie umgesetzt. Für die beiden Elektroden ergeben sich folgende Einzelreaktionen:
| Anodenreaktion: | 2 H2 -> 4 H+ + 4 e- |
| Kathodenreaktion: | 4 H+ + O2 + 4 e- -> 2 H2O |
Diese Darstellung zeigt die beiden entscheidenden Probleme bei der Entwicklung von Brennstoffzellen: Das richtige Elektrodenmaterial und die Beschaffenheit der Membran. Als Elektrodenmaterial werden in der Regel Edelmetalle wie Platin benutzt. Als protonenleitende Membranen kommen eine ganze Reihe von Materialien zum Einsatz allerdings ist hier die Forschung bei weitem noch nicht abgeschlossen. Das Problem hierbei ist, dass eine möglichst hohe Leitfähigkeit für Protonen oder Oxidionen erreicht werden muss, Wasserstoff- oder Sauerstoffmoleküle aber auf keinen Fall die Membran durchqueren dürfen. Je nach Kapazität und Anwendungsgebiet der Brennstoffzelle werden andere Membranen eingesetzt und entsprechend liegen die Betriebstemperaturen der Zellen je nach Membran zwischen etwa 50 °C und 1000 °C.
Die geschilderten Probleme lassen sich technisch allerdings schon recht gut lösen. Einem breitem kommerziellen Einsatz der Brennstoffzelle steht allerdings die zur Zeit fehlende Infrastruktur zur Versorgung der Konsumenten mit gasförmigem Wasserstoff entgegen, denn wo könnte man derzeit (Dezember 2017) als Ottonormalverbraucher Wasserstoff kaufen? Bis die Probleme der Lagerung, des Transports und insbesondere auch des Verkaufs ohne größere Risiken nicht besser und vor allem preiswerter gelöst werden können, wird die Brennstoffzellentechnik auf der Basis von Wasserstoff aus rein wirtschaftlichen Gründen nur schwer Fuß fassen können.
In der Zukunft sind die mit Wasserstoff betriebenen Brennstoffzellen allerdings möglicherweise von großer Bedeutung. Aktuell kaufen nach meiner Einschätzung die meisten Verbraucher unter anderem deshalb kein Elektroauto, weil die Reichweite gering und die Ladezeit lang ist. Eine Fahrt in den Urlaub kann zumindest ich mir damit nur schwer vorstellen. Hätte so ein Elektroauto eine Brennstoffzelle statt eines Lithiumionenakkus, würde ich damit einfach an die Wasserstofftankstelle fahren und Wasserstoff nachfüllen und der "Akku" wäre wieder voll - tanken ähnlich wie mit Benzin und fahren mit einem Elektroauto - sehr cool!
Energiebilanz und Wirkungsgrad
Die Brennstoffzelle nutzt Wasserstoff als Energiespeicher. Wie immer, muss auch hier die im Wasserstoff gespeicherte Energgie schon vorher vorhanden gewesen sein. D.h. theoretisch lassen sich maximal 100% der Energie im Wasserstoff speichern und auch maximal 100% dieser Energie wieder aus dem Wasserstoff heraus holen. Und ebenfalls wie immer: Diesen Traum kann man natürlich nicht erreichen. Nehmen wir an, 1 kWh elektrischer Energie steht uns aus Sonnen- oder Windenergie zur Verfügung - wie viel hiervon erhalten wir nach der Speicherung in Wasserstoff und Rückverwandlung in elektrische Energie maximal zurück?
Speicherung der Energie im Wasserstoff
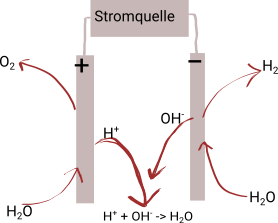
Wie man in der Abbildung sieht, wird zur Speicherung der Energie im Wasserstoff eine Elektrolyse des Wassers durchgeführt, d.h. das Wasser (Wasserstoffoxid) wird durch elektrischen Strom in Wasserstoff und Sauerstoff gespalten.
Hierzu wird eine Elektrolysezelle mit den beiden Polen einer Gleichstromquelle, z.B. einer Solarzelle, verbunden. Beide Pole in der Elektrolysezelle tauchen in Wasser ein. An der positiven Elektrode bildet sich aus dem Wasser Sauerstoff, während an der negativen Elektrode Wasserstoff gebildet wird.
An der positiven Elektrode, der Anode, werden den Wassermolekülen Elektronen entzogen; es findet eine Oxidation statt.
2 H2O -> O2 + 4 H+ + 4 e-
Hierbei geben formal zwei Wassermoleküle insgesamt vier Elektronen an den Pluspol der Stromquelle ab. Die zwei Wassermoleküle zerfallen hierdurch in ein Sauerstoffmolekül und vier Protonen bzw. Wasserstoffionen (H+).
An der negativen ELektrode, der Kathode, nimmt formal ein Wassermolekül ein Elektron auf. Dieses Wassermolekül zerfällt hierdurch in ein Hydroxidion (OH-) und ein einzelnes Wasserstoffatom (H). Zwei dieser Wasserstoffatome verbinden sich danach zu einem Molekül (H2), sodass sich ingesamt folgende Reaktion ergibt:
2 H2O + 2 e- -> H2 + 2 OH-
Wie man sieht, werden in der ersten Reaktion vier Elektronen freigesetzt, während in der Zweiten nur zwei "verbraucht" werden. Die zweite Reaktion muss also doppelt so oft ablaufen, wie die Erste. Hieraus ergibt sich als Gesamtreaktion:
2 H2O +2 ⋅ (2 H2O + 2 e-)
-> O2 + 4 H+ + 4 e- + 2 ⋅
(H2 + 2 OH-)
bzw.:
6 H2O + 4 e-
-> O2 + 4 H+ + 4 e- +
2 H2 + 4 OH-)
Die Protonen verbinden sich mit den Hydroxidionen zu Wasser (s. Abbildung), sodass sich schließlich als Gesamtreaktion der Elektrolyse folgendes ergibt:
2 H2O -> 2 H2 + O2
Der chemische Prozess der Wasserelektrolyse ist also genau die Umkehrung des Vorgangs in der Brennstoffzelle und sollte also exakt so viel Energie erfordern, wie aus dem obigen Brennstoffzellenprozess gewonnen werden kann. Klar - Träumer :-) Quatsch! Führt man die Elektrolyse tatsächlich so einfach wie hier beschrieben durch, gibt es eine ganze Reihe von Faktoren, die die Energiebilanz verhageln:
- Wasser ist normalerweise flüssig und die umgesetzten Wassermoleküle sind von anderen Wassermolekülen umgeben. Es ist Energie erforderlich, um diese "Umhüllung" aufzubrechen.
- Die beiden Prozesse an den Elektroden generieren Ionen, die sich später abseits der Elektrode wieder zu Wasser verbinden. Insgesamt vier Wassermoleküle werden in dem oben beschriebenen Prozess aus Ionen neu gebildet. Die Erzeugung dieser Ionen an den Elektroden hat elektrische Energie gekostet. Die Bildung des Wassers aus diesen Ionen liefert abseits der Elektroden Wärmeenergie. Diese Energie wurde also der Stromquelle entnommen aber nicht im Wasserstoff gespeichert.
- Die Protonen und die Hydroxidionen bewegen sich innerhalb der Elektrolysezelle aufeinander zu. Hierbei müssen sie den Widerstand des Mediums zwischen den Elektroden überwinden, wofür die Energie benötigen, die ebenfalls der Stromquele entnommen werden muss ohne im Wasserstoff gespeichert zu werden.
- Wasserstoff und Sauerstoff sind gasförmig und haben also einen viel größeren Platzbedarf als das Wasser, aus dem sie gebildet wurden. Die beiden Gase müssen sich also gegen den äußeren Luftdruck ausdehnen. Auch dazu brauchen sie Energie. Diese Energie kann allerdings vermutlich teilweise oder sogar vollständig aus der Wärmeenergie der Umgebung entnommen werden und muss also vermutlich nicht oder zumindest nicht komplett aus der Stromquelle stammen.
- Überspannung an der Elektrodenoberfläche: Damit eine Elektrolyse chemisch tatsächlich möglich ist, muss immer eine höhere Spannung angelegt werden, als theoretisch tatsächlich nötig wäre. Diese sogenannte Überspannung steigert den Energiebedarf relativ stark, lässt sich aber durch die Wahl eines geeigneten Elektrodenmaterials relativ weit minimieren.
- ....
Einige dieser Faktoren lassen sich vielleicht durch eine pfiffige Reaktionsführung vermeiden, andere minimieren aber es wird in jedem Fall mehr Energie nötig sein als hinterher tatsächlich im Wasserstoff gespeichert ist. Bereits 2004 wurden Wirkungsgrade bis "über 80 %" beschrieben (Quelle, abgerufen am 16.01.2018) Bei der wachsenden Bedeutung, die die Herstellung von Wasserstoff für unsere zukünftige Energieversorgung haben düfte, ist eine weitere Steigerung des technisch und wirtschaftlich sinnvoll erreichbaren Wirkungsgrades wahrscheinlich. 2010 (Quelle, abgerufen am 16.01.2018) wurden bereits über 90% beschrieben. Viel mehr ist nach meiner Einschätzung allerdings nicht mehr möglich.
Rückgewinnug der Energie durch der Brennstoffzelle
Der Wirkungsgrad der Brennstoffzelle hängt sehr wesentlich vom Kontruktionsprinzip der Brennstoffzelle ab. Eine sehr simple Umkehrung der einfachen Wassereleketrolyse, wie in der Abbildung zur Elektrolyse zu sehen, hat einen sehr geringen Wirkungsgrad. Technisch ausgefeilte Brennstoffzellentypen sind deutlich aufwändiger konstruiert und schwieriger zu betreiben, haben aber einen deutlich höheren Wirkungsgrad. Da sie aber alle nach dem gleichen Prinzip funktionieren, will ich hier nicht weiter auf die technischen Details eingehen.
Die Energieagentur.nrw veröffentlicht eine thermodynamische Berechnung des theoretischen Wirkungsgrades (abgerufen am 17.01.2018). Demnach wären theoretisch mehr als 80 % Wirkungsgrad möglich, d.h. theoretisch könnten mehr als 80 % der im Wasserstoff gespeicherten Energie als elektrische Energie zurück gewonnen werden. Laut der gleichen Quelle werden hiervon in der Praxis "bis zu 70 %" erreicht. Die "Brennstoffzellen + Batterie-Allianz-Baden-Würtemberg" beschreibt in einer Präsentation (Quelle, abgerufen am 17.01.2018) einen therotisch möglichen Wirkunsgrad von 83 % und einen aktuell technisch erreichbaren von bis zu 65 %.
Wirkungsgrad des Gesamtsystems
Gehen wir zurückhaltend von vielleicht 85 % Wirkungsgrad bei der Elektrolyse des Wassers zu Wasserstoff und Sauerstoff aus und von 65 % für die Brennstoffzelle. Nun gewinnen wir aus z.B. Sonnenenergie 1 kWh elektrische Energie, dann werden davon durch die Elektrolyse im Wasserstoff
1 kWh ⋅ 0,85 = 0,85 kWh
chemischer Energie gespeichert. Durch die Brennstoffzelle können hieraus dann
0,85 kWh ⋅ 0,65 = 0,55 kWh
elektrischer Energie zurück gewonnen werden. Der Gesamtprozess dürfte also einen Wirkungsgrad zwischen 50 und 60 % haben.
Fazit
Wenn wir ein Auto mit einer Wasserstoffbrennstoffzelle betrieben möchten, kommen zu den obigen Energieverlusten noch der Energieaufwand für die Speicherung von Wasserstoff und den Betrieb eines Elektromotors hinzu. Beide dürften aber nur gering sein, sodass wir vielleicht auf etwa 50 % Wirkunsgrad für ein mit einer Wasserstoffbrennstoffzelle betriebenes Auto kommen. Verglichen mit einem konventionellen Verbrennungsmotor ein traumhaft guter Wert! (vgl. hier) Im Vergleich zu Lithiumionen basierten Speichertechniken schneidet die Brennstoffzelle aber sehr schlecht ab. Nach übereinstimmenden Angaben vieler Internetquellen werden hier schon heute (Januar 2018) oft über 90 % erreicht, also weit mehr als das theoretische Maximum der Brennstoffzelle.
Denkt man darüber nach, Sonnen- und Windenergie in Zeiten des Überschusses, also bei viel Wind oder viel Sonne, in Wasserstoff zu speichern, ist ein Wirkungsgrad von nur wenig mehr als 50 % ein Albtraum. Fast die Hälfte der Energie bei der Speicherung zu verlieren ist nach meiner Auffassung nicht akzeptabel.
Brennstoffzellen mit Methanol
Neben Wasserstoff kommt auch z.B. Methanol als Brennstoff für Brennstoffzellen in Frage. Einem Betrieb mit Methanol steht allerdings entgegen, dass die kalte Verbrennung von Methanol ein viel komplizierterer chemischer Prozess ist, als die von Wasserstoff. Neben Wasser fällt hier auch gasförmiges Kohlendioxid (oder schlimmer noch Kohlemonoxid) als Abfallprodukt an. Außerdem ist die Umsetzung von Methanol zu Kohlendioxid und Wasser ein mehrstufiger Prozess, wodurch die Übertragung aller beteiligten Elektronen in einem Schritt sehr viel schwieriger wird.
Methanol betriebene Brennstoffzellen sind im Grunde genauso aufgebaut, wie mit Wasserstoff arbeitende. Methanol ist allerdings nicht unbegrenzt verfügbar und wird derzeit überwiegend aus fossilen Energieträgern oder aus Biomasse gewonnen. Im ersten Fall erzeugt der Prozess viel "fossiles" Kohlendioxid, im zweiten Fall konkurriert unsere Energieversorgung mit der Ernährung der Menschen. Im Schlimmsten Fall verhungern in armen Ländern Menschen, weil wir hier ein bisschen Strom machen möchten. Keine angenehme Vorstellung.
Nach meiner persönlichen Einschätzung werden Brennstoffzellen mit anderen Brennstoffen als Wasserstoff in Zukunft keine Bedeutung haben.
