Was ist Ozon?
Ozon - mein Laserdrucker stößt es aus, in der Ozonschicht ist ein Loch und im Sommer haben wir davon in der Stadt zu viel. Ozon scheint irgedwie besonders zu sein. Wenn es oben fehl, ist es doof und wenn wir es hier unten haben, ist es auch doof. Aber was ist nun Ozon?
Im Labor
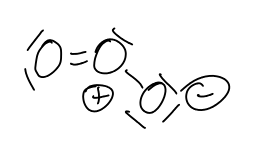
Ozon (O3) kann synthetisch in bis zu 10%iger Konzentration aus Sauerstoff durch Einwirkung einer stillen elektrischen Entladung hergestellt werden. Reines Ozon kann aus den so erhaltenen O2-O3-Gemischen durch fraktionierte Destillation erhalten werden. Reines, flüssiges Ozon (Siedepunkt -112 °C) ist tiefblaue, explosive Flüssigkeit.
Ozon bildet sich außerdem bei der Elektrolyse verdünnter Schwefelsäure und bei einigen, elementaren Sauerstoff erzeugenden chemischen Reaktionen.
In der Atmosphäre
In der Atmosphäre bildet sich Ozon unter Einwirkung von ultraviolettem Licht auf den Sauerstoff der Luft. Ozon bildet sich in der Stratosphäre durch ultraviolette Sonnenstrahlen im Bereich von 240-300 nm über die Reaktion:
O2 -> 2 O
O + O2 -> O3
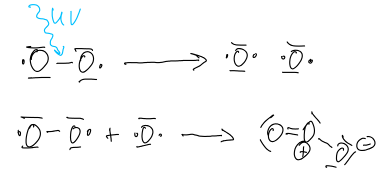
Für die Bildung des atomaren Sauerstoffs ist hierbei die Energie der UV-Strahlung nötig. Die Bildung des Ozons aus dem Sauerstoff-Radikal und dem molekularen Sauerstoff verläuft dann freiwillig.
Obwohl Ozon eine stark endotherme Verbindung ist, d.h. nicht stabil ist, (O3 -> 3/2 O2 ; ΔH = -142 kJ/mol) zerfällt es ohne Katalysatoren oder UV-Licht nur langsam.
Ozon absorbiert UV-Strahlung im Bereich von 200-360 nm. Hierbei wird das Ozon teilweise wieder abgebaut. Da Ozon durch UV-Strahlung gebildet und wieder zerstört wird und die UV-Strahlung dabei vernichtet wird ergibt sich...
- ...eine nahezu konstante Konzentration von Ozon in der Stratosphäre und
- ... eine weitestgehende Absorption der von der Sonne ausgehenden UV-Strahlung in der Stratosphäre.
Eine (teilweise) Zerstörung des Ozons in Stratosphäre könnte u.a. zu einer Zunahme der Oberflächentemperatur der Erde (nicht zu verwechseln mit dem Treibhauseffekt und auch völlig unabhängig von diesem) oder zu einem verstärktem Auftreten von Hautkrebs führen.
Ozonabbau
Neben Fluor-Chlor-Kohlenwasserstoffen (s. Ozonloch) können auch Stickoxide, wie NO und NO2, beispielsweise aus Flugzeugen, den Abbau der Ozonschicht katalysieren. (Stickoxide, die in Erdbodennähe entstehen erreichen wahrscheinlich niemals die Ozonschicht und sind somit nicht für das Ozonloch verantwortlich). Für diese katalytischen Reaktionen wird folgender Mechanismus beschrieben:
O3 + NO -> O2 + NO2
NO2 + O -> O2 + NO
oder
NO2 + O3 -> O2 + NO3
NO3 -> O2 + NO
Der letzte Schritt ist hierbei wieder von der UV-Strahlung abhängig. Da es sich bei dem obigen Mechanismus um eine katalysierte Reaktion handelt, die prinzipiell auch in der anderen Richtung, d.h. zur Ozonbildung, durchlaufen werden kann, werden NO und NO2 auch für den "Sommersmog" verantwortlich gemacht. Auch weil diese Stickoxide z.B. bei Verbrennungen unter hohen Temperaturen entstehen (etwa im Automotor) wird über den Stickoxidausstoß von Autos viel diskutiert, denn die hier freigesetzten Stickoxide könnten die Ozon-Konzentration in Bodennähe noch weiter erhöhen.
