Redoxreaktionen als Sauerstoffübertragungen
Chemischen Reaktionen mit Sauerstoff gehören zu den häufigeren Reaktionen in unserer Lebenswelt. Im Folgenden wird auf einfache Weise und überwiegend ohne Formeln erklärt, was eine Oxidation, eine Reduktion und eine Redoxreaktion ist und welche Bedeutung diese speziellen chemischen Reaktionen für unser Leben haben.
Oxidation
Reagiert ein Stoff mit Sauerstoff unter Sauerstoffaufnahme, ist diese chemische Reaktion eine Oxidation.
Die Definition verrät es bereits. Jede chemische Reaktion mit Sauerstoff ist eine Oxidation. Alle Verbrennungsprozesse sind also Oxidationen aber auch unsere Atmung, das Rosten von Eisen, die Bildung von Grünspan auf Kupfer, die Bräunung eines angebissenen Apfels, .... Die Liste könnte man endlos fortführen. Betrachten wir als Beispiel unsere Atmung genauer:
| Atemluft | Ausatemluft | |
|---|---|---|
| Stickstoff | 78 % | 78 % |
| Sauerstoff | 21 % | 17 % |
| Kohlenstoffdioxid | 0,04 % | 4 % |
| sonstiges | ca. 1% | ca. 1% |
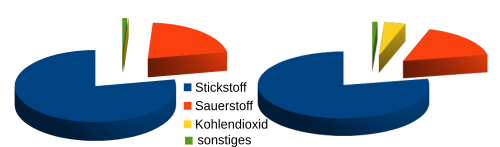
Wir atmen Luft ein, die zu 21 % aus Sauerstoff besteht und nur 0,04 % Kohlenstoffdioxid enthält. In der ausgeatmeten Luft sind dann nur noch 17 % Sauerstoff aber dafür 4 % Kohlenstoffdioxid enthalten. Da immer noch 78 % Stickstoff vorhanden ist, haben wir die Luftmenge nicht verringert, sondern Sauerstoff entfernt und im gleichen Maße Kohlenstoffdioxid hinzugefügt. Unser Körper hat also Sauerstoff verbraucht und Kohlenstoffdioxid erzeugt.
Da im Kohlenstoffdioxidmolekül ein Kohlenstoff enthalten ist, muss eine kohlenstoffhaltige Substanz aus unserem Körper mit dem Sauerstoff aus der Luft zu Kohlenstoffdioxid reagiert haben. Hierfür werden je nach Umständen in unterschiedlichem Ausmaß Kohlenhydrate und Fette in benutzt. Betrachten wir beispielhaft die Reaktion von Glukose (Traubenzucker) mit Sauerstoff:
Glukose + Sauerstoff -> Kohlenstoffdioxid + Wasser; exotherm
Diese exotherme chemische Reaktion deckt einen großen Teil des Energiebedarfs unseres Körpers. Im Reaktionsschema oben sieht man ohne Formelbetrachtung, dass Glukose unter Sauerstoffaufnahme reagiert; Glukose wird also oxidiert. Die Oxidationsprodukte sind Kohlenstoffdioxid und Wasser.
In der Reaktionsgleichung in Formelschreibweise sieht man die Sauerstoffaufnahme natürlich ebenfalls:
C6H12O6 + 6 O2 -> 6 CO2 + 6 H2O; ΔRH=-2808 kJ/mol
Jedes Glukosemolekül reagiert unter Aufnahme von sechs Sauerstoffmolekülen zu sechs Kohlenstoffdioxidmolekülen und ebenso vielen Wassermolekülen. Setzt man auf diese Weise ein mol Glucose um, erhält man 2808 kJ Energie. Das entspricht mit 372 kcal/100g genau dem physiologischen Brennwert von Glukose (Traubenzucker).
Reduktion
Reagiert ein Stoff unter Sauerstoffabgabe, ist diese chemische Reaktion eine Reduktion.
Eine Reduktion ist also die Umkehrung einer Oxidation. Betrachten wir beispielhaft die Reaktion bei der Photosynthese, die Umkehrung der bei der Atmung betrachteten Reaktion:
Kohlenstoffdioxid + Wasser -> Glukose + Sauerstoff; endotherm
Bei der Photosynthese reagiert Kohlenstoffdioxid aus der Luft mit Wasser zu Glukose und Sauerstoff. Die für diese endotherme chemische Reaktion benötigte Energie bekommen die Pflanzen aus dem Licht. Die Photosynthese läuft deshalb nur bei ausreichend Licht ab. Bei dieser Reaktion wird aus den Ausgangsstoffen Sauerstoff frei gesetzt. Die Edukte reagieren also unter Sauerstoffabgabe; sie werden reduziert.
In der Reaktionsgleichung in Formelschreibweise sieht man die Sauerstoffabgabe natürlich ebenfalls:
6 CO2 + 6 H2O -> C6H12O6 + 6 O2; ΔRH=2808 kJ/mol
Es reagieren sechs Kohlenstoffdioxidmoleküle mit sechs Wassermolekülen unter Freisetzung von sechs Sauerstoffmolekülen zu einem Molekül Glucose. Bei dieser Reaktion werden pro Mol gebildeter Glucose 2808 kJ Energie aufgenommen. Die Reaktion ist also in jeder Hinsicht die Umkehrung der bei der Oxidation betrachteten Atmungsreaktion.
Redoxreaktion
Reagiert ein Stoff mit einem anderen, sodass Sauerstoff von einem Stoff auf den anderen übertragen wird, ist dies eine Redoxreaktion. Es findet bei einer Oxidation gleichzeitig die Reduktion eines anderen Stoffes statt.
Das obige Beispiel lässt sich schlecht benutzen, um zu verdeutlichen, was eine Redoxreaktion ist. Wählen wir also ein Anderes. In unserer technischen Welt benutzen wir Metalle wie Eisen, Aluminium oder Kupfer und noch einige mehr für viele Dinge des täglichen Lebens. Anders als Gold kommen diese vergleichsweise unedlen Metalle in der Natur aber fast nicht in metallischer Form vor. Man findet sie überwiegend in Form ihrer "Erze", was häufig ein Gestein mit einem hohen Anteil an Oxiden oder Sulfiden des entsprechenden Metalls ist.
Nehmen wir mal an, wir hätten in unserem Garten viele millionen Tonnen Kupferoxid gefunden und wollten nun viele millionen Euros mit dem Verkauf des Kupfers verdienen - großartiger Plan :-). Damit das klappt, müssten wir das Kupfer wie folgt reduzieren:
Kupferoxid -> Kupfer + Sauerstoff; endotherm
2 CuO -> 2 Cu + O2; ΔRH = 314 kJ/mol
Leider ist diese Reaktion mit 314 kJ Energiebedarf pro 128 g Kupfer relativ stark endotherm. Wir müssten also ziemlich viel Energie hinzufügen. Außerdem würde das in dieser Reaktion entstehende Kupfer beim Abkühlen zumindest teilweise mit dem Sauerstoff wieder zu Kupferoxid reagieren. So richtig gut ist diese Reaktion nicht geeignet, um viele millionen Tonner Kupfer zu gewinnen. Man müsste auf einfache Weise relativ viel Energie hinzufügen und gleichzeitig den bei der Reaktion frei werdenden Sauerstoff entfernen können. Kombinieren wir also die obige Reduktion mit einer exothermen Oxidation, z. B. der von Kohlenstoff:
Kohlenstoff + Sauerstoff -> Kohlenstoffdioxid; exotherm
C + O2 -> CO2; ΔRH = -393 kJ/mol
Ein Kohlenstoffatom bindet ein Sauerstoffmolekül und setzt dabei gleichzeitig 393 kJ/mol Energie frei. Kombiniert man beide Reaktionen, sodass der Kohlenstoff durch den Sauerstoff des Kupferoxids oxidiert wird, während gleichzeitig das Kupfer durch den Kohlenstoff reduziert wird, erhält man folgende exotherme Redoxreaktion:
Kupferoxid + Kohlenstoff -> Kupfer + Kohlenstoffdioxid; exotherm
2 CuO + C -> Cu + CO2; ΔRH = -79 kJ/mol
Die Oxidation des Kohlenstoffs liefert also so viel Energie, dass der Gesamtprozess exotherm wird und pro 128 g Kupfer noch 79 kJ Energie frei setzt. Gleichzeitig wird durch die Oxidation des Kohlenstoffs der Sauerstoff gebunden und somit entfernt, sodass das Kupfer nicht wieder oxidiert wird. Da Kohlenstoff in Form von Kohle auf der Erde (noch) in relativ großen Mengen verfügbar ist, löst diese Redoxreaktion also alle unsere Probleme und dem Reichtum steht nichts mehr im Wege außer vielleicht das fehlende Kupferoxid in unserem Garten.
