Ausgleichen von Redox-Gleichungen
Kurzanleitung
Das Ausgleichen von Redox-Gleichungen ist eine häufige Aufgabe in der Chemie und fällt vielen Menschen schwer. Dabei ist es eigentlich ganz einfach, wenn man die folgende Vorgehensweise einhält:
- Bestimme die Oxidationszahlen aller (relevanten) Atome.
- Bestimme hieraus das oxidierte Atom und die Anzahl der von ihm abgegebenen Elektronen.
- Verfahre in gleicher Weise mit dem reduzierten Atom.
- Berechne das kleinste gemeinsame Vielfache der beiden zuvor bestimmten Elektronenzahlen. Ergänze stöchiometrische Faktoren vor den Verbindungen, die das oxidierte bzw. das reduzierte Atome enthalten, sodass die "kleinstes Vielfaches" bestimmte Anzahl an Elektronen übertragen wird.
- Passe die stöchiometrischen Faktoren der restlichen an der Reaktion beteiligten Komponenten an.
Beispiele
Natrium reagiert mit Chlor
Diese Reaktion, bei der Natriumchlorid entsteht, ist eigentlich ganz einfach auszugleichen.
Natrium + Chlor → Natriumchlorid
2 Na + Cl2 → 2 Na+ + 2 Cl-
Im Grunde sind die paar Zahlen hier schnell ergänzt und die Reaktion ist einfach ausgeglichen. Der ganze Zirkus mit den Oxidationszahlen kommt einem total überflüssig vor - und ist es hier auch. Trotzdem fangen wir mit diesem einfachen Beispiel an, eben weil es so einfach ist.

Die Elemente Natrium und Chlor haben vor der Reaktion die Oxidationszahl ±0. Nach der Reaktion hat das Chlorid die Oxidationszahl -I - jedes Chloratom hat also ein Elektron aufgenommen. Es wurde reduziert. Das Natrium hat hingegen ein Elektron abgegeben, wurde also oxidiert.
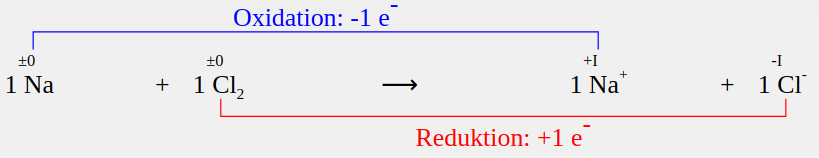
Daraus ergeben sich die folgenden Gleichungen für die Reduktion und die Oxidation:
- Red: Cl2 +2 e- → 2 Cl-
- Ox: Na → Na+ + e- | · 2
Da immer zwei Chloratome in einem Molekül sind, werden bei der Reduktion mindestens zwei Elektronen übertragen. Bei der Oxidation ist es mindestens eines. Das kleinste gemeinsame vielfache ist zwei. Bei dieser Reaktion muss man also die Oxidation zwei Mal machen, damit die Reduktion ein Mal geht.

Ergänzen wir die fehlenden stöchiometrischen Faktoren vor dem Natriumatom (Na), dem Natriumion (Na+) und auch die noch fehlende 2 vor dem Chloridion (Cl-), erhalten wir genau die Redox-Gleichung, die wir oben schon einfach so aufstellen konnten. So weit, so einfach. Übertragen wir nun dieses Vorgehen auf ein Beispiel, dass wir nicht mehr so ohne weiteres ausgleichen können.
Herstellung von Chlor aus Salzsäure und Kaliumpermanganat
Dies ist eine beliebte Reaktion, um im kleinen Maßstab im Labor oder auch in der Schule Chlor für einzelne Versuche zu gewinnen. An der Reaktion nehmen aus der Salzsäure das Chloridion (Cl-) und das Proton (H+) teil. Außerdem reagiert aus dem Kaliumpermanganat nur das Permanganation (MnO4-). Man erhält Manganionen (Mn2+), Chlor (Cl2) und Wasser.
Cl- + MnO4- + H+ → Cl2 + Mn2+ + H20
Diese Reaktionsgleichung jetzt "einfach so" auszugleichen ist schon eher mühsam und kann etwas länger dauern. Mit dem oben beschreibenen Vorgehen dauert es hingegen nicht länger als für jede andere Gleichung auch. Bestimmen wir zunächst die Oxidationszahlen:

Das Mangan ändert im Verlauf der Reaktion seine Oxidationszahl von +VII auf +II; es wird reduziert und nimmt bei der Reaktion fünf Elektronen auf. Beim Chlor ändert sich hingegen die Oxidationszahl von -I auf ±0; es wird oxidaiert und jedes Chlorid gibt ein Elektron ab.

Daraus ergeben sich die folgenden Teilgleichungen für die Oxidation und die Reduktion:
- Ox: 2 Cl- → Cl2 + 2 e- | · 5
- Red: MnO4- + 5 e- + 8 H+ → Mn2+ + 4 H2O | · 2
Bei dieser Reaktion muss immer eine gerade Anzahl an Chloridionen umgesetzt werden, weil sie nach der Oxidation ein zweiatomiges Molekül (Cl2) bilden. Die kleinste Zahl Elektronen, die dadurch bei der Oxidation frei wird, ist zwei. In der Reduktion des Mangans werden jedes Mal fünf Elektronen aufgenommen. Das kleinste gemeinsame Vielfache aus zwei und fünf ist zehn. In der Redoxreaktion müssen also 10 Elektronen übertragen werden.

Zum Ausgleichen der Reaktion schreiben wir also 10 Cl- für zehn Chloridionen und entsprechend viele Elektronen. Hieraus werden fünf Chlormoleküle (5 Cl2). Außerdem werden zwei Permanganation benötigt, aus denen zwei Manganionen werden.
Zum Schluss ergänzen wir noch die stöchiometrischen Faktoren für Wasser und Protonen: Aus den zwei Permanganationen erhält man acht Sauerstoffatome, die insgesamt acht Wassermoleküle bilden. Für diese acht Wassermoleküle braucht man sechzehn Protonen auf der linken Seite.
Weitere Beispiele
Im Prinzip ist die Vorgehensweise immer gleich und ich könnte jetzt noch 753 weitere Beispiele beschreiben, aber das wäre schrecklich langweilig. Hier findest Du eine Anleitung zur Bestimmung der Oxidationszahlen und für weitere Beispiele habe ich Dir hier einen Übungskasten gebaut, mit dem Du selbst Redoxreaktionen ausgleichen kannst. Deine Eingaben werden überprüpft und eventuelle Fehler werden angezeigt, sodass Du sie korrigieren kannst - probier es einfach aus.
