Aggregatzustände
Nahezu jeder Stoff kann, je nach Temperatur, in den drei Aggregatzuständen fest, flüssig oder gasförmig vorliegen.
Änderung des Aggregatzustands
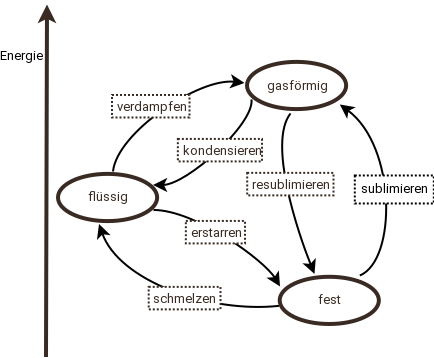
| vorher | Umwandlung | nachher |
|---|---|---|
| fest | schmelzen | flüssig |
| flüssig | erstarren | fest |
| flüssig | verdampfen | gasfömig |
| gasförmig | kondensieren | flüssig |
| fest | sublimieren | gasförmig |
| gasförmig | resublimieren | fest |
Wie man sieht, lassen sich die Stoffe in andere Aggregatzustände überführen. Dies gelingt normalerweise durch Temperaturänderung - "höhere" Aggregatzustände erreicht man durch Temperaturerhöhung, tiefere durch Abkühlung.
Zunächst überraschend ist, dass offenbar einige Stoffe direkt von fest nach gasförmig wechseln können, ohne zwischendurch flüssig zu sein. Dies ist tatsächlich möglich - diese Stoffe können dann normalerweise nicht flüssig sein. Kohlendioxid ist hierfür ein Beispiel. Bei normalem Luftdruck kommt es nur fest und gasförmig vor. Unterhalb von -78 °C ist es fest, darüber gasförmig. Flüssiges Kohlendioxid kann man nur durch Druckänderungen erhalten.
Ein anderes Beispiel hierfür das Gefriertrocken von Lebensmitteln oder auch das Trocknen von Wäsche auf der Leine bei Frost. In beiden Fällen wird festes Wasser direkt gasförmig ohne zwischendurch flüssig zu sein. Anders als bei der Sublimation des Kohlendioxids ist hierfür aber nicht die Temperatur verantwortlich, sondern die geringe Menge Wasser in der das Eis umgebenden Atmosphäre.
Erhitzen eins Feststoffes
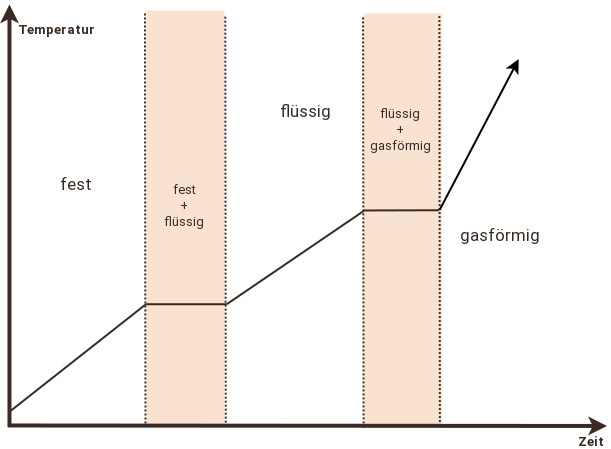
Nehmen wir in einem Gedankenexperiment einen Eisblock aus einem -20 °C kalten Gefrierschrank und legen ihn in den 250 °C heißen Backofen, so beobachtet man idealisiert betrachtet, dass sich die Temperatur des Wassers wie in dem Diagramm dargestellt verändert.
Zunächst steigt die Temperatur konstant bis zum Schmelzpunkt von 0°C an. Das gesamte Wasser ist bis hierin fest. Der konstante Anstieg kommt daher, dass dem Wasser durch den Backofen konstant Energie zugeführt wird.
Ab dem Augenblick, an dem der Schmelzpunkt erreicht ist, ändert sich die Temperatur des Wassers nicht mehr. Stattdessen nimmt die Menge des festen Wassers stetig ab, während die des Flüssigen beständig zunimmt. Die weiterhin zugeführte Energie wird also nicht mehr zur Temperaturerhöhung verwendet, sondern zur Änderung des Aggregatzustandes. Schmelzen eines Stoffes erfordert also Energie - die "Schmelzwärme".
Wenn das Wasser vollständig geschmolzen ist, nimmt die Temperatur wieder konstant zu. Die Energie wird also zur Temperaturerhöhung des jetzt flüssigen Wassers verwendet. Allerdings steigt die Temperatur nun langsamer an, als bei dem festen Wasser - um eine Temperaturerhöhung um ein Grad Celsius zu bewirken ist bei flüssigem Wasser also mehr Energie erforderlich als bei Festem - die "Wärmekapazität" des flüssigen Wassers ist höher.
Bei 100 °C, also dem Siedepunkt von Wasser, bleibt die Temperatur erneut trotz andauernder Energiezufuhr konstant. Die hier zugeführte Energie wird benutzt, um das Wasser zu Verdampfen. Zum Verdampfen eines Stoffes ist also Energie nötig - die "Verdampfungswärme". Während des Verdampfens nimmt die Menge des flüssigen Wassers stetig ab, während die des gasförmigen Wassers zu nimmt. Letzteres könnte man aber nicht sehen, da gasförmiges Wasser aussieht wie "Luft".
Wenn das Wasser vollständig verdampft ist, man also kein Wasser mehr sehen kann, nimmt die Temperatur des nun gasförmigen Wassers wieder konstant zu. Da gasförmiges Wasser eine geringere Wärmekapazität hat, erreicht man mit der gleichen Menge Energie eine größere Temperatursteigerung als bei flüssigem Wasser, weshalb der Temperaturanstieg nun wieder steiler verläuft.
Phänomene aus dem Alltag
Schwitzen
Wenn uns warm ist, schwitzen wir. Jeder weiß es aber warum hat die Natur unseren Körper diesen scheinbar sinnlosen Flüssigkeitsverlust spendiert? Für unsren Stoffwechsel ist es unabdingbar, dass die Körpertemperatur ziemlich genau 37 °C beträgt. Abweichungen davon sind doof, weil die biochemischen Prozesse, die uns am Leben halten, dann schlechter oder sogar garnicht mehr funktionieren.
Wenn die Temperatur fällt, muss der Körper also heizen - dazu muss die Muskelaktivität erhöht werden um mehr Energie umzusetzen und so mehr Wärme zu erzeugen. Muskelaktivität zum Heizen ohne größere Bewegung - zittern!
Kühlen ist weit schwieriger. Dazu muss der Körper mehr Wärmeenergie an die Umgebung abgeben. Hierzu überzieht er die Haut mit Wasser, dass dann verdunstet. Die zur Verdunstung nötige Energie wird dabei der Umgebung, also bevorzugt der Haut und somit also der obersten Körperschicht entzogen, die sich durch diesen Energieverlust abkühlt. Wir schwitzen also, um unseren Körper durch den Entzug der Verdampfungswärme des Schweißes zu kühlen.
Aus dem gleichen Grund ist uns kalt, wenn wir nass sind. Die Verdampfungswärme des Wassers beim Trocknen wird unserer Haut entzogen und wir frieren.
Eiswürfel im Getränk
Wenn Eiswürfel einige Zeit an der Bar in einer Schale gelegen haben, ist ihre Temperatur auf 0 °C angestiegen. Wenn man nun in ein Getränk 50 g Eiswürfel gibt, könnte man denken, dass 50 ml 0 °C kaltes Wasser den gleichen Effekt haben könnten. Diese Idee ist aber total falsch. 50 ml 0 °C kaltes Wasser in 150 ml 20 °C warmen Getränk führen zu 200 ml einer Flüssigkeit mit etwa 15 °C - also eine nur geringe Temperaturabsenkung verbunden mit einer realtiv starken Verdünnung.
Nimmt man stattdessen 50 g Eis mit 0 °C wird zunächst die Schmelzwärme der Eiswürfel dem Getränk entzogen, wodurch sich sein Temperatur bereits um etwa 26 °C verringern würde - alleine die Schmelzwärme der 50 g Eis reicht also aus, um das gesamte Getränk auf 0 °C abzukühlen und es bleibt sogar noch ein bisschen Eis als Puffer übrig.
