Das Massenwirkungsgesetz
Wie schon in der Beschreibung des chemischen Gleichgewichts erwähnt, sind im Gleichgewicht die Hin- und Rückreaktion gleich schnell. Zusammen mit der mathematischen Beschreibung der Reaktionsgeschwindigkeit lässt sich damit das chemische Gleichgewicht mathematisch beschreiben. Hierdurch wird die Zusammensetzung eines Reaktionsgemisches im Gleichgewicht berechenbar.
Herleitung
Im Gleichgewichtszustand entstehen durch die Hinreaktion in jedem Augenblick genau so viele Produktmoleküle, wie durch die Rückreaktion wieder verschwinden. Die Hin- und die Rückreaktion sind also gleich schnell.
vhin = vrück
Nehmen wir eine allgemeine Gleichgewichtsreaktion folgender Art
a · A + b · B ⇄ d · D + e · E
wobei die Kleinbuchstaben a, b, d, und e die stöchiometrischen Faktoren und die Großbuchstaben A, B, D und E die Summenformeln darstellne, so erhalten folgende Gleichungen für die Reaktionsgeschwindigkeit
a · A + b · B ⇄ d · D + e · E
vhin = khin · ca(A) · cb(B)
vrück = krück · cd(D) · ce(E)
wobei c jeweils die Stoffmengenkonzentration in mol/L ist.
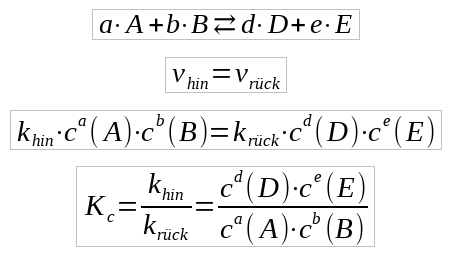
Die Abbildung zeigt die Herleitung des sogenannten Massenwirkungsgesetzes. Hier wird zunächst für die allgemeine Reaktion die Gleichgewichtsbedingung vhin = vrück angewendet, was mit den mathematischen Ausdrücken für die beiden Reaktionsgeschwindigkeiten zu dem Term in der vorletzten Zeile führt. Durch einfaaches umstellen erhält man dann das Massenwirkungsgesetz in seiner allgemeinen Form.
Die Gleichgewichtskonstnate Kc ist definiert als Quotient der Reaktionsgeschwindigkeitskonstanten k: Kc= khin/krück
Interpretation der Gleichgewichtskonstanten
Die Gleichgewichtskonstante Kc ist tatsächlich eine konstante, was ziemlich aufregende Konsequenzen hat. Im ersten Augenblick könnte man denken, dass sich der Wert der Gleichgewichtskonstante aus den Konzentrationen ergibt. Tatsächlich ist es aber genau umgekehrt: Aus der Gleichgewichtskonstanten ergeben sich die Konzentrationen der Stoffe im Gleichgewicht. Nehmen wir an, dass wir für irgendeine Reaktion in irgendeinem Tabellenwerk finden, Kc sei 4. Dann bedeutet diese Information, dass sich bei dieser Reaktion im Gleichgewicht alle Konzetrationen immer (!) genau so einstellen, dass der Bruch des Massenwirkungsgesetzes immer 4 ergibt. Die Konzentrationen stellen sich also durch die Reaktion genau so ein, dass das Produkt der Produktkonzentrationen exakt vier mal so groß ist, wie das Produkt der Eduktkonzentrationen. Solange dieser Zustand nicht erreicht ist, befindet sich das System im Ungleichgewicht und die Zusammensetzung der Mischung ändert sich. Das Ziel dieser Änderung ist in diesem Fall, dass der Konzentrationsbruch den Wert 4 annimmt. Wenn dieser Zustand dann erreicht ist, bleiben die Konzentration unverändert und von außen gesehen kommt die Reaktion zum Stillstand. Das System befindet sich dann im Gleichgewicht.
Einheit der Gleichgewichtskonstante
An der obigen Herleitung kann man mit etwas mathematischer Erfahrung schon erkennen, dass die Einheit der Gleichgewichtskonstante nicht immer gleich ist. Normalerweise haben naturwissenschaftliche Kontanten einen Zahlenwert und eine definierte Einheit. Bei der Massenwirkungskonstante ist das im Prinzip auch so, allerdings sind sowohl der Zahlenwert als auch die Einheit für jede Reaktion unterschiedlich. Betrachten wir ein paar Beispiele:
HCl ⇄ H+ + Cl- ergibt
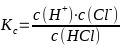
Da die Konzentration die Einheit mol/L besitzt, ergibt sich in diesem Fall für die Massenwirkungskonstante ebenfalls die Einheit mol/L
2 HI ⇄ I2 + H2 ergibt
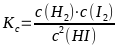
Da in diesem Fall Zähler und Nenner des Bruches die gleiche Einheit haben, resultiert für Kc keine Einheit.
