Elementsymbole und Formeln
Die meisten Menschen kennen chemische Symbole und halten etwa CO2 für die „Abkürzung“ von Kohlenstoffdioxid und H2O für die von Wasser. Diese Annahme ist jedoch aus chemischer Sicht falsch. Diese Symbole sind im eigentlichen Sinne keine „Abkürzungen“; vielmehr handelt es sich dabei um Molekülformeln (s.u.).
Elementsymbole
Alle chemischen Elemente können durch Symbole dargestellt werden, jedoch meint S nicht etwa den Stoff Schwefel, obwohl es das Elementsymbol des Schwefels ist. Stattdessen meint S ein einzelnes Schwefelatom, 3 S meint drei Schwefelatome und wer 17 C schreibt, der meint 17 Kohlenstoffatome. C ist demnach keine „Abkürzung“ für das Element Kohlenstoff; streng genommen wäre das sogar ein Fehler. Die Elementsymbole und einige weitere Informationen über die Atome jedes Elementes lassen sich aus dem Periodensystem der Elemente entnehmen.
Verhältnisformel
Natriumchlorid (Kochsalz) gehört wie alle Mineralien, Gesteine, Keramiken,... zu den salzartigen Verbindungen. Die Kristalle dieser Stoffe bestehen aus gitterartigen Anordnungen sehr vieler, fest miteinander verbundener Atome. Jeder Natriumchloridkristall enthält dabei genau so viele Natrium- wie Chloratome. Aber natürlich enthalten verschieden große Kristalle unterschiedlich viele Atome - aber immer gleich viele Natrium- wie Chloratome.
Die chemische Formel solcher salzartiger Verbindungen kann also keine Aussage über die absolute Anzahl der Atome treffen, denn die ist ja in jedem Kristall anders. Stattdessen gibt sie "nur" die Art der Atome und das Atomanzahlverhältnis an; bei Natriumchlorid also Natrium- und Chloratome im Anzahlverhältnis 1 zu 1. Man schreibt das Anzahlverhältnis als kleine, tief gestellte Ziffern hinter die Elementsymbole: Na1Cl1. Die Eins wird normalerweise weggelassen, sodass man i.d.R nur NaCl schreibt. Aluminiumoxid enthält Aluminium- und Sauerstoffatome im Anzahlverhältnis 2 zu 3. Die Verhältnisformel lautet entsprechend Al2O3. Die meisten Verbindungen, die Metall- und Nichtmetallatome enthalten, gehören zu den salzartigen Verbindungen und werden durch eine Verhältnisformel beschrieben.
In der Verhältnisformel steht das Metallatom immer vorne. Außerdem gibt man immer das kleinst mögliche Atomanzahlverhältnis an - Na2Cl2 wäre demnach falsch, da beide Koeffizienten durch zwei teilbar sind und das kleinst mögliche Verhältnis 1 zu 1 wäre.
Molekülformel
Die Molekülformel gibt die Art und die genaue Anzahl der Atome in einem Molekül an. Moleküle sind kleinste Teilchen aus einigen fest miteinander verbundenen Atomen. Zwischen zwei Molekülen bestehen nur schwache Anziehungskräfte. Ein Wassermolekül besteht aus genau zwei Wasserstoffatomen und einem Sauerstoffatom. Die Molekülformel lautet entsprechend H2O1. Ein Traubenzuckermolekül besteht aus genau sechs Kohlenstoff-, sechs Sauerstoff und zwölf Wasserstoffatomen. Die Molekülformel lautet also C6H12O6. In der Molekülformel werden die Elementsymbole normalerweise in alphabetischer Reihenfolge angegeben. Außerdem enthalten Moleküle nur sehr selten Metallatome.
Der entscheidende Unterschied
Moleküle...

Bei einer Molekülverbindung wie Wasser sind nur wenige Atome fest miteinander verbunden. Beim Wasser sind es immer genau drei: Zwei Wasserstoffatome und ein Sauerstoffatom (H2O). Zu benachbarten Wassermolekülen bildet diese "Dreiergruppe" nur sehr schwache Anziehungkräfte aus. Diese Anziehungskräfte sind so gering, dass sie bereits bei 100 °C durch die Bewegungsenergie der Wassermoleküle überwwunden werden. Oberhalb von 100 °C ist Wasser deshalb gasförmig, besteht aber immer noch aus Wassermolekülen der obigen Zusammensetzung. Wasserdampf besteht also chemisch genau so aus Wasser wie flüssiges Wasser nur mit mehr Energie.
... und Salze
Die Verhältnisformel von Kochsalz (NaCl) sieht der Molekülformel des Wassers sehr ähnlich und doch beschreibt eine Verhältnisformel einen völlig anderen Zustand: Im Kochsalz ist jedes Natriumatom von sechs Chloratomen umgeben und fest jedem davon verbunden. Ebenso ist jedes Chloratom von sechs Natriumatomen umgeben und ebenso fest mit ihnen verbunden. Es entsteht also ein "unendliches" Gitter bei dem jedes Atom mit jedem seiner sechs andersartigen Nachbarn fest verbunden ist. An der Kante des Kristalls wird diese schöne Regelmäßigkeit gestört und die Umgebung der "Kantenatome" unterscheidet sich von der der inneren Atome, weshalb Oberflächen oft sehr spannende physikalische Eigenschaften zeigen - aber das ist hier ja nicht das Thema.
Die Verhältnisformel NaCl beschreibt also einen Stoff, der aus vielen Kristallen besteht innerhalb derer sich in jedem Fall gleich viele Natrium- wie Chloratome befinden. Im Prinzip ist jeder Kristall ein "Molekül" (zumindest in der obigen Vorstellungen von Molekülen) des Salzes. Da nun leider alle Kristalle verschieden viele Atome enthalten, lässt sich aber keine Molekülformel angeben.
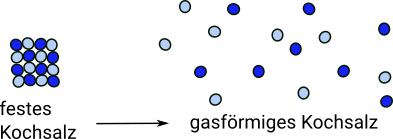
Wenn man nun eine salzartige Verbindung über den Siedepunkt hinaus erhitzt, wird sie ebenso gasförmig wie eine Molekülverbindung. Allerdings sind im Gas eines Salzes die Kristalle nicht mehr vorhanden. Es ist also zum Verdampfen eines Salzes nötig die Kristalle zu zerstören, was bedeutet, dass man im Falle des Natriumchlorids die Natriumatome von den fest mit ihnen verbundenen Chloratomen entfernt und umgekehrt. In gasförmigen Salzen kommen also eigentlich die Salze selbst nicht mehr vor. Beim Natriumchlorid trennt man die Natrium- von den Chloratomen, sodass sie einzeln und getrennt voneinander im Gas vorkommen. Da man zm Verdampfen also die Verbindung zwischen den Atomen des Salzes aufbrechen muss, ist dazu sehr viel Energie nötig. Deshalb haben salzartige Verbindungen i.d.R. einen viel höheren Siedepunkt als Molekülverbindungen.
... und was hier falsch beschrieben wurde
Dieser Text ist primär für Menschen gedacht, die sich Atome bislang noch als massive Kugeln vorstellen und noch nichts über Ionen oder chemische Bindungen wissen. Für diese Zielgruppe habe ich die Welt so sehr vereinfacht, dass ich es selbst schon beinahe falsch finde :-) In salzartigen Stoffen sind die Atome in einer Weise miteinander verbunden,die die Atome verändert. Diese Veränderung bleibt auch beim Verdampfen erhalten. Gasförmiges Kochsalz enthält also kein Natrium und auch kein Chlor :-) sondern ist immer noch gasförmiges Kochsalz, weil die Veränderung an den Atomen durch das Verdampfen nicht rückgängig gemacht wird, auch wenn die Atome voneinander entfernt werden.
Formeln bei chemischen Reaktionen
Chemische Reaktionen werden normalerweise ebenfalls als in Formeln dargestellt. Betrachten wir als Beispiel die bei der Photosynthese ablaufende Reaktion zur Bildung von Glucose (Traubenzucker) und Sauerstoff aus Wasser und Kohlenstoffdioxid:
Wasser + Kohlenstoffdioxid ⟶ Glucose + Sauerstoff; endotherm
In der obigen Wortgleichnung wird die Reaktion in "Stoffen" dargestellt. Links vom Pfeil stehen die Ausgangsstoffe (Edukte) und rechts vom Pfeil die Produkte. Diese Wortgleichung gibt also an, welche Stoffe miteinander zu welchen anderen Stoffen reagieren. Links vom Pfeil stehen die Stoffe, die man vor der Reaktion hat und rechts die, die man danach hat.
Man könnte jetzt denken, dass einfach die Namen der Stoffe durch die jeweiligen Formeln ersetzt werden könnten, also
- Wasser durch H2O,
- Kohlenstoffdioxid durch CO2,
- Glucose durch C6H12O6 und
- Sauerstoff durch O2
In diesem Fall hätte man aber die Molekülformeln als "Abkürzungen" der Namen verwendet und die erhaltene Gleichung wäre falsch. C6H12O6 sagt ja aus, dass dieses eine Molekül Glucose aus genau sechs Kohlenstoffatomen, zwölf Wasserstoffatomen und sechs Sauerstoffatomen besteht. Da Atome unzerstörbar sind und auch nicht erzeugt werden können, muss die genau gleiche Anzahl Atome auch schon vor der Reaktion, also links vom Pfeil, vorhanden gewesen sein. Für eine korrekte Reaktionsgleichung bräuchten wir also pro gebildetem Glucosemolekül sechs Kohlenstoffdioxidmoleküle für die sechs Kohlenstoffatome. Außerdem bräuchten wir für die zwölf Wasserstoffatome sechs Wassermoleküle (6 H2O). Wir hätten dann zwölf Sauerstoffatome aus dem Kohlenstoffdioxid sowie sechs Sauerstoffatome aus dem Wasser, insgesamt also 18 Sauerstoffatome, von denen sechs sich im Glucosemolekül finden. Bleiben also zwölf Sauerstoffatome übrig, die in Form von sechs Sauerstoffmolekülen frei werden. Die gesamte Reaktionsgleichung sieht dann folgendermaßen aus:
6 CO2 + 6 H2O ⟶ 1 C6H12O6 + 6 O2; endotherm
Die 1 kann wieder weg gelassen werden, sodass man schließlich folgendes erhält:
6 CO2 + 6 H2O ⟶ C6H12O6 + 6 O2; endotherm
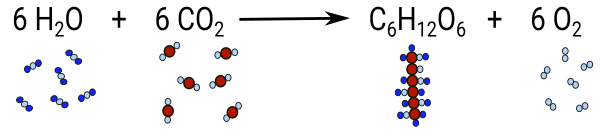
Wie schon oben bei den Elementsymbolen, Molekül- und Verhältnisformeln trifft auch hier die Formel eine Aussage über die Art und die genaue Anzahl der an einer Reaktion beteiligten Atome und enthält somit viel mehr Informationen als die "einfache" Wortgleichung mit den beteiligten Stoffen.
